INTRODUÇÃO
A insuficiência cardíaca é uma das principais causas de mortalidade em pacientes com miocardiopatia isquêmica. As opções terapêuticas atuais propostas, tanto clínicas como cirúrgicas, têm como principal objetivo tratar apenas as conseqüências do infarto do miocárdio e não a causa básica, que é a perda da célula contrátil, o cardiomiócito.
Apesar de alguns autores sugerirem que haja divisão mitótica do coração [1], a grande maioria dos cardiomiócitos não tem a capacidade de regeneração após o infarto do miocárdio e quando isto ocorre existe uma deterioração da atividade contrátil e quando esta área é extensa pode ocorrer o remodelamento ventricular. Recentemente, a recuperação da função contrátil tem sido evidenciada por meio da terapia celular, tornando-a uma opção terapêutica viável. Entretanto, a escolha do melhor tipo de célula ainda é motivo de discussão. Os dois tipos celulares que estão sendo mais utilizados são os mioblastos esqueléticos e as células da medula óssea.
As células mioblásticas esqueléticas mostraram resultados factíveis em vários estudos experimentais [2-6] e um estudo clínico [7], pois puderam se diferenciar em fibra esquelética na fibrose miocárdica. Entretanto, ainda existem controvérsias com relação à não diferenciação destas células em cardiomiócitos, à ausência de conexão entre as células transplantadas e os cardiomiócitos nativos e o seu potencial arritmogênico. Um estudo multicêntrico chamado MAGIC está sendo realizado e poderá esclarecer algumas dúvidas pendentes.
Por outro lado, as células da medula óssea são pluripotentes e com capacidade de se diferenciarem do meio dependente [8]. As células da medula óssea podem sofrer dois processos de diferenciação [9]: as células mononucleares (indiferenciadas) e as multinucleares. Dentre as células mononucleares, existe a hematopoiética, que originará células do sangue (linfócitos, eosinófilos, basófilos, neutrófilos, células vermelhas e plaquetas) e a mesenquimal, que poderá originar células musculares, hepatócitos, osteócito, tecido adiposo, condrócitos e estroma.
Alguns estudos sugerem uma melhora da função cardíaca após o transplante das células da medula óssea no miocárdio [10], outros uma diferenciação em cardiomiócitos [11] e outros, ainda, apenas um potencial angiogênico [12].
Alguns estudos utilizaram as células mesenquimais [13], outros as hematopoiéticas [14] e outros, ainda, a porção mais primária - as mononucleares [15], com diferentes resultados, tanto funcionais como anátomo-patológicos. Existem métodos e custos distintos de isolamento destas frações celulares da medula óssea. Desta forma, o objetivo deste trabalho é comparar o resultado funcional e anátomo-patológico do transplante das células mononucleares e mesenquimais no miocárdio infartado com disfunção ventricular.
MÉTODO
Modelo Experimental - Infarto do Miocárdio
Todos os experimentos foram realizados no Laboratório de Terapia Celular da PUCPR, de acordo com o "Guia de Cuidados de Animais", aprovado pela Sociedade Americana de Fisiologia.
Ratos Wistar com peso médio de 250 a 300 gramas foram anestesiados com a administração de 50mg/kg de ketamina e 10mg/kg de xylazina, ambas por via intraperitoneal. Os animais foram submetidos à entubação endotraqueal, sem exposição da traquéia e à ventilação mecânica com freqüência de 60 ciclos/min, com 2,5 ml de volume ("683" Harvard®. Apparatus, Inc., USA).
Todos os animais foram submetidos à toracotomia lateral esquerda, pela qual foi realizada a ligadura da artéria coronária esquerda com fio polipropilene 7.0 (Ethicon®, Inc., Somerville, NJ), induzindo o infarto da parede ântero-lateral do ventrículo esquerdo. Foi comprovada a efetividade do procedimento quando houve alteração da coloração da parede ventricular esquerda. Houve uma mortalidade de 40% dos animais submetidos ao procedimento.
Após sete dias do infarto do miocárdio, os animais foram novamente submetidos à anestesia com a administração de 50mg/kg de ketamina e 10mg/kg de xylazina, ambas por via intraperitoneal e a avaliação ecocardiográfica transtorácica bidimensional [Hewlet Packard modelo Sonos 5500, com transdutores setorial S12 (5-12 mHz) e limiar 15L6 (7-15mHz)], permitindo uma análise de até 160Hz e especificamente produzida para estudo ultra-sônico em pequenos animais. O transdutor foi posicionado na porção ântero-lateral esquerda do tórax e os corações foram visualizados pelo modo bidimensional com visão axial do ventrículo esquerdo, incluindo a valva mitral, aórtica e o ápice na mesma imagem. A conversão digital da imagem foi obtida pela delimitação do septo interventricular e da parede posterior do ventrículo esquerdo. A seguir, realizaram-se as seguintes medidas: superfície sistólica e diastólica finais, comprimento sistólico e diastólico finais do ventrículo esquerdo e freqüência cardíaca para cálculos dos volumes sistólicos (VSFVE, ml) e diastólicos (VDFVE, ml) finais e da fração de ejeção (FEVE%) do ventrículo esquerdo. Todas as medidas foram realizadas de forma cega, pelo mesmo ecocardiografista, três vezes, sendo em seguida calculada a média de cada parâmetro. Somente foram incluídos no estudo os animais com fração de ejeção do ventrículo esquerdo inferior a 30%. Os animais que apresentaram fração de ejeção superior a 30% foram excluídos do estudo, o que correspondeu a 27%.
A partir deste momento, os animais foram divididos em três grupos: 1) controle - constituído por 21 animais, 2) mononuclear (MO) - constituído por oito animais e 3) mesenquimal (ME) - constituído por 13 animais.
Preparo e isolamento das células
Coleta da medula óssea
Os animais foram anestesiados, posicionados em decúbito lateral e, em seguida, foi realizada a antissepsia.
A medula óssea foi aspirada através de múltiplas punções de ambas as cristas ilíacas posteriores com seringas heparinizadas de 5ml (liquemine 5000U/ml). O material foi encaminhado para o Laboratório Experimental de Cultivo Celular para o isolamento das células mononucleares. Para cada 100 ml de meio de cultivo (DMEM), foi utilizado 1 ml de heparina.
Isolamento das células mononucleares
A suspensão de medula óssea foi diluída em meio essencial de Eagle modificado por Dulbecco (DMEM) e colocada lentamente sob o gradiente de densidade Ficoll-Hypaque (densidade = 1.077 g/mL), de acordo com Boyum1968. O material foi centrifugado a 1400 rpm por 40 minutos. O anel de células mononucleares, localizado na interfase, foi retirado e passado para um tubo cônico, contendo 20 mL de meio DMEM. As células foram lavadas 2x a 1500 rpm por 10 minutos e ressuspendidas com meio DMEM. Foi realizada a contagem celular em câmera de Neubauer e verificada a viabilidade celular, utilizando o corante vital Azul de Tripan.
Cultivo e expansão das células mesenquimais
As células foram plaqueadas numa concentração de 500.000 células/mL em frascos de cultivo celular com 25 cm2 de área em 5 mL de meio DMEM suplementado com 10% de soro bovino fetal, 1% de antibiótico penicilina e sulfato de estreptomicina e 10µL/mL de fator semelhante à insulina (IGF-I, Sigma -USA).
Os frascos foram incubados numa estufa com 5% de tensão de CO2 a 37ºC e o meio foi trocado quando houve a confluência celular. As células aderentes foram dissociadas utilizando tripsina-EDTA 0,25% (Gibco - USA) e novamente plaqueadas para expansão celular por 14 dias (Figura 1).
Transplante das células
Oito dias após o infarto do miocárdio, os ratos foram submetidos ao transplante celular. Os animais foram anestesiados com 50mg/kg de ketamina e 10mg/kg de xylazina e submetidos à esternotomia mediana transesternal e dissecadas as aderências. A região de fibrose miocárdica, na parede ântero-lateral do ventrículo esquerdo, foi identificada. Foi realizada a injeção das células da medula óssea, na parede anterior do ventrículo esquerdo, da seguinte maneira: grupo 1) controle (n=21), que recebeu 0,15 ml de meio de cultura na região do infarto; 2) mononuclear (MO) (n=8) que recebeu 3x106 de células mononucleares e 3) mesenquimal (ME) que recebeu 3x106 de células mesenquimais (n=13). Todos os animais receberam ciclosporina 15 mg/Kg/peso/dia logo após a injeção das células, pois o transplante foi heterólogo.
Análise funcional
Um mês após o transplante, a análise funcional do ventrículo esquerdo foi realizada por meio da ecocardiografia pelos mesmos parâmetros previamente descritos. Sob os animais anestesiados, o transdutor foi posicionado na porção ântero-lateral esquerda do tórax e o coração foi visualizado usando o modo bidimensional com visão axial do ventrículo esquerdo, incluindo a valva mitral, a aórtica e o ápice na mesma imagem. A conversão digital da imagem foi obtida delimitando o septo interventricular e a parede posterior do ventrículo esquerdo. O volume diastólico final do ventrículo esquerdo (VDFVE, ml), o sistólico final do ventrículo esquerdo (VSFVE, ml) e a fração de ejeção (FEVE, %) foram calculados por meio de fórmulas clássicas. Todas as análises ecocardiográficas foram realizadas de forma cega, três vezes e pelo mesmo ecocardiografista e uma média foi calculada. Após o procedimento, os animais foram sacrificados com uma supradosagem anestésica.
Análise histológica
Os corações foram removidos e lavados com PBS (Gibcco-USA) e criopreservados em nitrogênio líquido. Secções transversais de 8µm foram realizadas pelo criostato (Leica, modelo 1850). As peças foram analisadas morfologicamente pelo método de Tricrômio de Gomery.
Análise estatística
Os resultados foram expressos por média ± desvio padrão e valores de p<0,05 indicaram significância estatística. Nas comparações intra-grupos entre a avaliação de base e a avaliação após um mês foi usado o teste t de Student para amostras pareadas. Após avaliar a homogeneidade das variâncias e a distribuição normal dos dados, a comparação dos grupos na avaliação de base foi feita usando-se a análise de variância. Para a comparação dos grupos após um mês foi usada a análise de covariância, considerando-se os resultados de base como co-variável. O teste LSD foi usado para as comparações múltiplas. O teste não-paramétrico de Kruskal-Wallis foi usado na comparação dos grupos, quando apropriado.
RESULTADOS
Análise ecocardiográfica
Análise dos grupos isoladamente
Fração de ejeção do ventrículo esquerdo (26,84 ± 7,05% vs 21,79 ± 8,77% vs 26,62 ± 7,34% p=0,2505), volume sistólico final do ventrículo esquerdo (0,46 ± 0,14ml vs 0,43 ± 0,10ml vs 0,40 ± 0,11ml p=0,3260) e volume diastólico final do ventrículo esquerdo (0,63 ± 0,15ml vs 0,56 ± 0,14ml vs 0,54 ± 0,13ml, p=0,1891) não apresentaram diferença significativa entre si, no período pré-transplante nos grupos controle, mononuclear e mesenquimal, respectivamente. Os três grupos foram considerados homogêneos.
Um mês após o transplante, a FEVE apresentou um decréscimo significativo no grupo controle (26,84 ± 7,05% para 22,32 ± 6,94%, p=0,0045) e manteve-se estável nos grupos mononuclear e mesenquimal (21,79 ± 8,77% para 18,60 ± 6,11%, p=0,4232 e 26,62 ± 7,34% para 25,55 ± 10,21%, p=0,6505, respectivamente) -Tabela 1.
No parâmetro do VSFVE, neste mesmo período, identificou-se um acréscimo significativo no grupo controle (0,46 ± 0,14 ml para 0,60 ± 0,17ml, p=0,0001), mononuclear (0,43 ± 0,10ml para 0,77 ± 0,13ml, p=0,0002) e mesenquimal (0,40 ± 0,11ml para 0,52 ± 0,18ml, p=0,0003) - Tabela 2.
No parâmetro do VDFVE, neste mesmo período, foi identificado um acréscimo significativo no grupo controle (0,63 ± 0,15 ml para 0,76 ± 0,17ml, p=0,0013), mononuclear (0,56 ± 0,14ml para 0,95 ± 0,18ml, p=0,0003) e mesenquimal (0,54 ± 0,13ml para 0,69 ± 0,17ml, p<0,0001).
Análise dos grupos entre si
Após um mês do transplante das células, não se identificou, no parâmetro da FEVE%, diferença estatística entre os grupos controle, mononuclear e mesenquimal (22,32 ± 6,94% vs 18,60 ± 6,11% vs 25,55 ± 10,21%, p=0,2980, respectivamente). Neste mesmo período, nos parâmetros dos volumes ventriculares VSFVE (0,60 ± 0,17ml vs 0,77 ± 0,13ml vs 0,52 ± 0,18ml p=0,0005) e VDFVE (0,76 ± 0,17ml vs 0,95 ± 0,18ml vs 0,69 ± 0,17ml p=,0002), foram identificadas diferenças estatísticas entre os grupos controle, mononuclear e mesenquimal, respectivamente.
Histologia
A análise histológica do grupo controle identificou grande quantidade de fibrose, e sem a evidência de nenhum outro tecido formado (Figura 2).
A análise do grupo mononuclear identificou a presença de neovasos e células endoteliais na região de fibrose (Figuras 3 e 4).
A análise do grupo mesenquimal identificou a presença de neovasos, células endoteliais e células musculares lisas (Figuras 5 e 6).
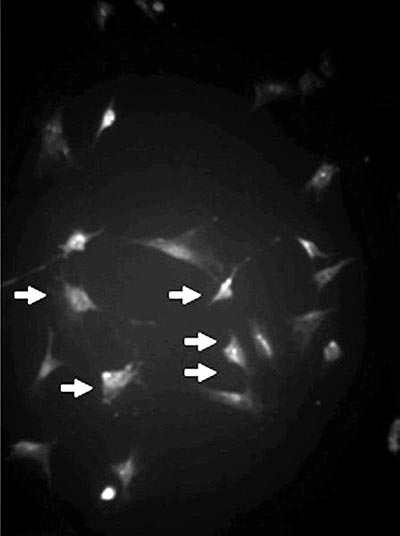
Fig. 1 - Cultura de células mesenquimais (flechas) identificadas pelo anticorpo anti-vimentina (Imunofluorescência, x 200)

Fig. 2 - Infarto do miocárdio (IM) - Tricrômio de Gomery, x400
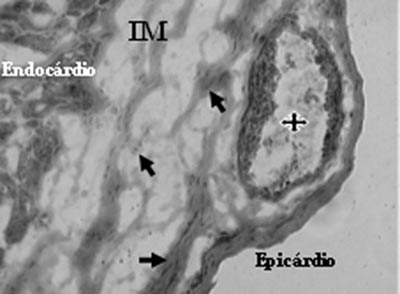
Fig. 3 - Neovasos com lúmen (estrela) e células endoteliais (flechas), após o transplante de células mononucleares no infarto do miocárdio (IM) - Tricrômio de Gomery, x200
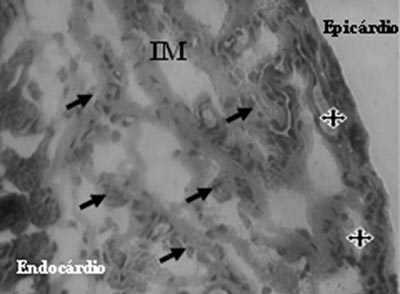
Fig. 4 - Células endoteliais (flechas) e neovasos (estrelas) identificadas após o transplante de células mononucleares no infarto do miocárdio (IM) - Tricrômio de Gomery, x200
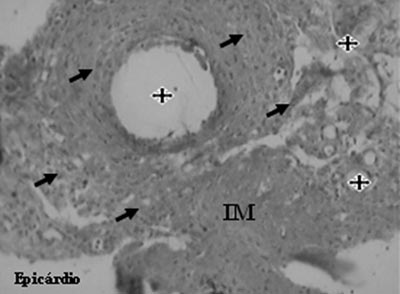
Fig. 5 - Neovasos (estrelas) e células endoteliais (flechas) após o transplante de células mesenquimais no infarto do miocárdio (IM) - Tricrômio de Gomery, x200
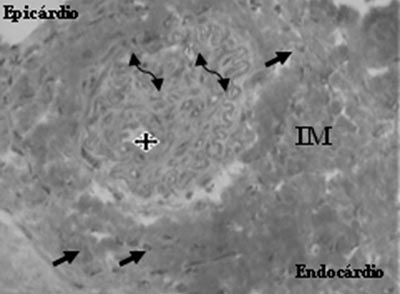
Fig. 6 - Neovaso formado (estrela), células endoteliais (flechas) e células musculares lisas (flechas duplas), após o transplante de células mesenquimais no infarto do miocárdio (IM) - Tricrômio de Gomery, x400


COMENTÁRIOS
O objetivo principal do transplante de células no miocárdio infartado é a colonização da região fibrosada com novas células contráteis para recuperar a função contrátil do ventrículo esquerdo. Em nosso estudo, em um modelo de infarto crônico do miocárdio com fibrose já estabelecida, identificamos que as células da medula óssea, tanto as mononucleares como as mesenquimais, apresentaram resultados semelhantes, entretanto, algumas diferenças devem ser discutidas.
O transplante de células da medula óssea no miocárdio tem apresentado resultados distintos em vários trabalhos, tanto experimentais como clínicos. Importante lembrar que existem as diferentes frações de células da medula óssea sendo utilizadas como terapêutica no miocárdio (mononucleares, mesenquimais e hematopoiéticas), assim como diferentes modelos de doença miocárdica, onde as células estão sendo transplantadas (fibrose transmural, isquemia miocárdica e miocárdio hibernado) e, como conseqüência, diferentes resultados funcionais, clínicos e anátomo-patológicos.
Existem ainda outros autores que preconizam apenas a mobilização das células da medula óssea circulante, estimulados pelo G-CSF. Os resultados sugerem o poder de recuperação do miocárdio infartado [16].
Com relação ao transplante de células mononucleares, Orlic et al. [17] têm demonstrado o benefício do transplante das células na zona de transição do miocárdio infartado e miocárdio íntegro, após oclusão coronária. Foi identificado que parte da região infartada foi colonizada com novos tecidos: cardiomiócitos e vasos sangüíneos. Neste estudo, as células da medula óssea foram transplantadas em uma região ainda com músculo cardíaco viável, pois as células mononucleares foram transplantadas na zona de transição entre o miocárdio íntegro e o infartado, onde existe miocárdio hibernante, o que é compreensível que possam se diferenciar em cardiomiócitos.
Por outro lado, Bel et al. [12] injetaram células mononucleares em um modelo de infarto do miocárdio, com fibrose já estabelecida. Identificou-se, após 30 dias do transplante das células, deterioração da função ventricular, tanto no grupo controle, como no grupo que recebeu as células. Com relação à histologia, não se identificou nenhum novo tecido contrátil formado na fibrose miocárdica, apenas maior presença de macrófagos e novos vasos sangüíneos. Desta forma, os autores sugerem precaução em relação ao real benefício do transplante das células da medula óssea.
Um importante estudo clínico com células da medula óssea foi realizado por Wollert et al. [18], no qual os pacientes foram submetidos ao tratamento do infarto agudo do miocárdio por meio da angioplastia intracoronária (ATC) e após dois tratamentos distintos: medicamentoso e transplante de células da medula óssea. Os autores sugerem melhora funcional importante do grupo que recebeu células da medula óssea em relação ao grupo que recebeu tratamento clínico. Estes resultados são muito interessantes, entretanto, devem ser analisados com certas restrições, pois o artigo refere-se ao tratamento do infarto agudo do miocárdio por meio da ATC e não ao transplante isolado de células da medula óssea. O benefício do transplante de células da medula óssea é superior quando comparado ao tratamento clínico após a angioplastia intracoronária, entretanto, ambos os grupos apresentaram melhora clínica após a ATC e não somente o grupo tratado com células da medula óssea. Fisiologicamente não foi o transplante de células da medula óssea isoladamente que promoveu a melhora funcional do coração, mas sim a ATC.
Outro estudo [13] no qual se comparou o resultado do transplante de células da medula óssea e os mioblastos esqueléticos, em um modelo de infarto do miocárdio com fibrose transmural, identificou-se melhora funcional do grupo que recebeu células de origem esquelética, entretanto, o grupo que recebeu células da medula óssea apresentou estabilização da função. À histologia, foi identificada a presença de novas fibras de origem esquelética, no grupo mioblasto e novos vasos sangüíneos, no grupo que recebeu células da medula óssea, o que justifica a não melhora funcional do grupo que recebeu células da medula óssea. Entretanto, a estabilização da sua função e não a piora pode ser explicada, pois, diferentemente dos mioblastos, as células da medula óssea podem exercer mecanismos que limitam a progressão do infarto, provavelmente pela neoangiogênese.
Em nosso estudo, com relação à análise funcional no período pré-transplante, os três grupos apresentaram os parâmetros da fração de ejeção, volumes sistólico e diastólico finais do ventrículo esquerdo sem diferença estatística entre si, comprovando a homogeneidade entre os grupos. O modelo experimental utilizado foi o de infarto do miocárdio com fibrose estabelecida e disfunção ventricular grave, pois os animais incluídos no estudo apresentavam a média da fração de ejeção do ventrículo esquerdo inferior a 27%.
O grupo controle apresentou uma deterioração importante de fração de ejeção do ventrículo esquerdo, após 30 dias do infarto do miocárdio, com p=0,0045, comprovando o efeito da necrose muscular e como conseqüência a insuficiência cardíaca, o que já era de se esperar. Tanto o grupo que recebeu células mononucleares, como o que recebeu células mesenquimais, apresentou resultados semelhantes, apesar de não apresentarem melhora da fração de ejeção do ventrículo esquerdo, ambos apresentaram estabilização funcional, com p=0,4232 e p=0,6505, respectivamente, entre o período após o infarto e 30 dias do transplante celular.
Com relação ao volume diastólico final do ventrículo esquerdo, os três grupos estudados apresentaram aumento de seus valores, trinta dias após a injeção das células. No grupo controle, em conseqüência de deterioração da função ventricular pós-infarto, já havia uma previsão que ocorreria dilatação e remodelamento ventricular. Entretanto, com relação aos grupos que receberam as células, apesar da estabilização da fração de ejeção do ventrículo esquerdo, também foram identificados dilatação e remodelamento ventricular, neste mesmo período.
O volume sistólico final do ventrículo esquerdo, também nos três grupos estudados, apresentou aumento dos seus valores neste mesmo período, sugerindo perda da capacidade contrátil em todos os animais submetidos ao estudo. Como na análise do volume diastólico final, o aumento do volume sistólico final do ventrículo esquerdo no grupo controle já era esperado em conseqüência da evolução do infarto do miocárdio, mas estes dados também foram semelhantes nos grupos que receberam as células.
Com relação ao aumento dos volumes ventriculares (VDFVE e VSFVE), mesmo após o transplante das células, acredita-se que este efeito está diretamente relacionado à evolução natural da doença de base. Como foram incluídos no estudo animais com fração de ejeção inferior a 30% e como já existe uma disfunção ventricular grave com aumento dos volumes ventriculares, previamente ao transplante, é difícil compreender que o transplante de células possa exercer um mecanismo anti-remodelamento, pois o tratamento é apenas regional. Além do que, à anatomia patológica, foram identificados apenas novos vasos sangüíneos na região de infarto onde as células foram transplantadas.
Desta forma, apesar dos mecanismos de limitação da progressão do infarto após a terapia celular proposta por Garot et al. [19], a terapia com células da medula óssea, tanto mononucleares como mesenquimais, no infarto crônico do miocárdio, em nosso estudo, não exerceu o efeito anti-remodelamento. Uma justificativa para este fato é que o transplante de ambos os tipos celulares foi realizado na parede anterior do ventrículo esquerdo, assim o seu efeito foi apenas regional. Outra explicação para o remodelamento ventricular, identificado em todos os animais que receberam células, pode estar relacionada ao modelo do estudo experimental utilizado, pois os animais que foram submetidos ao transplante já apresentavam previamente disfunção ventricular grave, com aumento dos volumes ventriculares. Alguns estudos realizaram o transplante de células da medula óssea em corações sem disfunção ventricular severa, que na evolução podem apresentar resultados distintos dos encontrados em nosso estudo.
Com relação à anatomia patológica, a análise foi apenas morfológica e comparativa entre os grupos que receberam células e o grupo controle. Na região de infarto do miocárdio foram identificadas células endoteliais em ambos os grupos que receberam células. No grupo que recebeu células mesenquimais, além das células endoteliais, também foram identificadas células musculares lisas, fazendo parte da estrutura vascular neoformada. Não foram identificadas fibras musculares estriadas na região de infarto onde as células foram transplantadas. O grupo controle apresentou apenas fibrose transmural. Desta forma, compreende-se que a não melhora funcional dos grupos onde foram realizados os transplantes das células se deve ao fato de não terem sido identificadas novas células contráteis estriadas na região infartada.
Os mecanismos que podem explicar porque os grupos que receberam células mononucleares e mesenquimais apresentaram estabilização da fração de ejeção do ventrículo esquerdo são fundamentados pela presença da angiogênese identificada na região transplantada. Estes novos vasos formados podem aumentar o aporte sangüíneo na zona de transição entre o miocárdio infartado e o íntegro, elevando a contratilidade de células hibernadas e também prevenindo apoptoses. Alguns autores ainda acreditam que as células mononucleares da medula óssea apresentam um efeito anti-inflamatório, identificado em animais com doença de Chagas [20]. Outros, ainda, sugerem que as células da medula óssea podem estimular a produção de proteínas citoprotetoras (HsPS, HsP32,HsP70 e VEGF) [21] .
Silva et al. [22] também identificaram apenas uma melhora da perfusão miocárdica em animais com disfunção ventricular grave em um modelo de isquemia miocárdica, da mesma forma que Bel et al. [12], em animais com disfunção ventricular severa em um modelo de infarto do miocárdio e fibrose. Thompson et al. [23], também em um modelo de infarto do miocárdio com fibrose, não identificaram cardiomiócitos na zona de necrose miocárdica, em um grupo que recebeu células mononucleares da medula óssea; eles foram localizados apenas na zona de transição entre o miocárdio íntegro e o infartado.
Um dos mais importantes resultados funcionais realizados após o transplante de células mononucleares foi realizado por Marzullo [24], que fez duas análises de uma região fibrose miocárdica, por meio de cintilografia miocárdica: a da perfusão e da contração miocárdica. Na análise da perfusão miocárdica, identificou-se um aumento da irrigação sangüínea no local em que as células foram transplantadas, ao passo que quando a análise foi da contração miocárdica, este resultado não foi evidenciado. Sugerindo que o transplante de células da medula óssea na fibrose miocárdica transmural pode melhorar a perfusão, mas não a contração miocárdica.
Levando-se em consideração que as células da medula óssea têm uma característica de diferenciação meio dependente [8], como podemos compreender que as mesmas possam se diferenciar em cardiomiócito em plena fibrose miocárdica transmural? Por outro lado, quando as células da medula óssea são injetadas em um modelo de isquemia miocárdica, com células ainda viáveis ou na zona de transição entre o infarto do miocárdio e o miocárdio íntegro ou, ainda, onde existe a presença de fibrose miocárdica entremeada com miocárdio íntegro, esta transdiferenciação é justificável e compreensível.
Quanto a algumas diferenças de resultado funcional e anátomo-patológico do nosso estudo em relação a alguns estudos da literatura, é importante diferenciar que o modelo de estudo utilizado em nosso trabalho foi o do infarto crônico do miocárdio, com fibrose já estabelecida, diferentemente de outros autores, que utilizam o infarto agudo [25], isquemia miocárdica [22] ou miocárdio hibernado [23]. Sabe-se que os mecanismos de regeneração miocárdica do infarto agudo, crônico e isquemia miocárdica são distintos, desta forma, os resultados também.
Com relação ao isolamento das diferentes frações de células da medula óssea, as células mononucleares são obtidas após um processo mais simples do que as mesenquimais, pois necessitam apenas passar por dois processos de centrifugação e pelo gradiente de densidade Ficoll-Hypaque (método de Boyum) [26], ao passo que as células mesenquimais necessitam passar por estes mesmos processos e após, ainda, pela cultura e expansão celular por aproximadamente 14 a 16 dias, apresentando assim custos mais elevados e com riscos maiores de contaminação.
Com relação aos resultados funcionais entre as células mononucleares e mesenquimais, eles foram sobreponíveis nos parâmetros avaliados. Com relação à anatomia patológica, ambas apresentaram neoangiogênese, entretanto, um pouco mais completa no grupo que recebeu células mesenquimais, pela presença de células musculares lisas.
Como a característica principal das células da medula óssea é a neoangiogênese, acreditamos que elas possam ser uma excelente opção para o tratamento de miocárdios hibernados, sem condições técnicas de cirurgia de revascularização miocárdica e/ou angioplastia coronária e ainda em pacientes resistentes ao tratamento clínico medicamentoso.
CONCLUSÃO
Os dados identificados neste estudo sugerem que tanto o grupo que recebeu células mononucleares, quanto o grupo que recebeu células mesenquimais, apresentou estabilização da fração de ejeção do ventrículo esquerdo de forma homogênea e regeneração vascular, entretanto, sem o efeito anti-remodelamento ventricular quando transplantadas no infarto do miocárdio.
AGRADECIMENTO
À CAPES.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Kajstura J, Leri A, Finato N, Di Loreto C, Beltrami CA, Anversa P. Myocyte proliferation in end-stage cardiac failure in humans. Proc Natl Acad Sci USA. 1998;95(15):8801-5.
2. Ghostine S, Carrion C, Guarita-Souza LC, Bruneval P, Vilquin JT, Pouzet B et al. Long-term efficacy of myoblast transplantation on regional structure and function after myocardium infarction. Circulation. 2002;106(12 suppl. l):I-131-6.
3. Guarita-Souza LC, Carvalho RG, Pouzet B, Vilquin JT, Garcin I, Menasché P et al. The transplant of cardiac cells and myoblast skeletal cells in myocardial infarction. Rev Bras Cir Cardiovasc. 2002;17(4):312-22.
4. Murry CE, Wiseman RW, Schwartz SM, Hauschka SD. Skeletal myoblast transplantation for repair of myocardial necrosis. J Clin Invest. 1996;98(11):2512-23.
5. Scorsin M, Hagège A, Vilquin JT, Fiszman M, Marotte F, Samuel JL et al. Comparison of the effects of fetal cardiomyocyte and skeletal myoblast transplantation on post-infarction left ventricular function. J Thorac Cardiovasc Surg. 2000;119(6):1169-75.
6. Taylor DA, Atkins BZ, Hungspreugs P, Jones TR, Reedy MC, Hutcheson KA et al. Regenerating functional myocardium: improved performance after skeletal myoblast transplantation. Nat Med. 1998;4(8):929-33.
7. Menasche P, Hagege AA, Vilquin JT, Desnos A, Abergel E, Pouzet B et al. Autologous skeletal myoblast transplantation for severe post-infarction left ventricular dysfunction. J Am Coll Cardiol. 2003;41(7):1078-83.
8. Verfailie C.M. Adult stem cells: assessing the case for pluripotency. Trends Cells Biol. 2002;12(11):502-8.
9. Friedenstein AJ, Petrakova KV, Kurolesova AI, Frolova GP. Heterotopic of bone marrow: analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation. 1968;6(2):230-47.
10. Wang JA, Fan YQ, Li CL, He H, Sun Y, Lv BJ et al. Human bone marrow-derived mesenchymal stem cells transplanted into damaged rabbit heart to improve heart function. J Zhejiang Univ Sci B. 2005;6(4):242-8.
11. Deb A, Wang S, Skelding KA, Miller D, Simper D, Caplice NM et al. Bone marrow-derived cardiomyocytes are present in adult human heart: a study of gender-mismatched bone marrow transplantation patients. Circulation. 2003;107(9):1247-9.
12. Bel A, Messas E, Agbulut O, Richard P, Samuel JL, Bruneval P et al. Transplantation of autologous fresh bone marrow into infarcted myocardium: a word of caution. Circulation. 2003;108(Suppl 1):II247-52.
13. Guarita-Souza LC, Carvalho K., Rebelatto C, Miyague N, Furuta M, Scorsin M et al Effectiveness of skeletal myoblasts and bone marrow stromal cells transplantation on post-infarct ventricular dysfunction. Circulation. 2003;108(17), Suppl: IV-218.
14. Agbulut O, Vandervelde S, Al Attar N, Larghero J, Ghostine S, Leobon B et al. Comparison of human skeletal myoblasts and bone marrow-derived CD133+ progenitors for the repair of infarcted myocardium. J Am Coll Cardiol. 2004;44(2):458-63.
15. Perin EC, Dohmann HF, Borojevic R, Silva SA, Souza AL, Mesquita CT et al. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure. Circulation. 2003;107(18):2294-302.
16. Orlic D, Kajstura J, Chimenti S, Limana F, Jakoniuk I, Quaini F et al. Mobilized bone marrow cells repair the infarcted heart improving function and survival. Proc Natl Acad Sci USA. 2001;98(18):10344-9.
17. Orlic D, Kajstura J, Chimenti S, Jakoniuk I, Anderson SM, Li B et al. Bone marrow cells regenerate infarcted myocardium. Nature. 2001;410(6829):701-5.
18. Wollert KC, Meyer GP, Lotz J, Ringes-Lichtenberg S, Lippolt P, Breidenbach C et al. Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial. Lancet. 2004;364(9429):141-8.
19. Garot J, Unterseeh T, Teiger E, Champagne S, Chazaud B, Gherardi R et al. Magnetic resonance imaging of targeted catheter-based implantation of myogenic precursor cells into infarcted left ventricular myocardium. J Am Coll Cardiol. 2003;41(10):1841-6.
20. Soares MB, Lima RS, Rocha LL, Takyia CM, Carvalho AC, Ribeiro-dos-Santos R et al. Transplanted bone marrow cells repair heart tissue and reduce myocarditis in chronic chagasic mice. Am J Pathol. 2004;164(2):441-7.
21. Penn MS, Francis GS, Ellis SG, Young JB, McCarthy PM, Topol EJ. Autologous cell transplantation for the treatment of damaged myocardium. Prog Cardiovasc Dis. 2002;45(1):21-32.
22. Silva GV, Litovsky S, Assad JA, Sousa AL, Martin BJ, Vela D et al. Mesenchymal stem cells differentiate into an endothelial phenotype, enhance vascular density, and improve heart function in a canine chronic ischemia model. Circulation. 2005;111(2):150-6.
23. Thompson RB, Emani SM, Davis BH, Van den Bos EJ, Morimoto Y, Craig D et al. Comparison of intracardiac cell transplantation: autologous skeletal myoblasts versus bone marrow cells. Circulation. 2003;108(suppl 1):II-264-71.
24. Marzullo P. Nuclear imaging after cell implantation. Int J Cardiol. 2004;Supll 1, S53-S54.
25. Orlic D, Kajstura J, Chimenti S, Bodine DM, Leri A, Anversa P. Transplanted adult bone marrow cells repair myocardial infarcts in mice. Ann N Y Acad Sci. 2001;938:221-9.
26. Boyüm A. Isolation of mononuclear cells and granulocytes from human blood: isolation of mononuclear cells by one centrifugation and of granulocytes by combining centrifugation and sedimentation at 1g. Scand J Clin Lab Invest Suppl. 1968;97:77-89.








 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license