INTRODUÇÃO
A plastia da valva mitral é a técnica de referência no tratamento da regurgitação [1,2]. Qualquer que seja a lesão, Carpentier tem demonstrado, com muita propriedade, que o reparo da valva mitral é durável e oferece a melhor opção terapêutica no que diz respeito à recuperação do ventrículo esquerdo e à qualidade de vida. A ressecção quadrangular é uma técnica cirúrgica estabelecida para o reparo da cúspide posterior (CP) prolapsada [1]. Alguns dados ainda apóiam o conceito de que o reparo da cúspide anterior (CA) é mais desafiador e não oferece tão bons resultados a longo prazo como o da CP. O prolapso da CA pode ser tratado por diferentes técnicas: encurtamento de cordas tendíneas [1], no caso de cordas alongadas, transferência de cordas tendíneas, no caso de ruptura e substituição de cordas tendíneas [3], em ambos os casos. O fato é que o encurtamento de cordas tem sido progressivamente abandonado, enquanto a substituição de cordas tendíneas tem crescido no reparo da valva mitral. Essas duas técnicas, usadas por inúmeros cirurgiões, apresentam limitações e resultados questionáveis [4,5]. Em nossa experiência, reparamos o prolapso da cúspide anterior com uma técnica reproduzível e segura: o reposicionamento do músculo papilar (RMP) [6,7]. O objetivo do estudo foi descrever a técnica e os resultados para propô-la como procedimento padrão.
MÉTODO
População e características da valva mitral
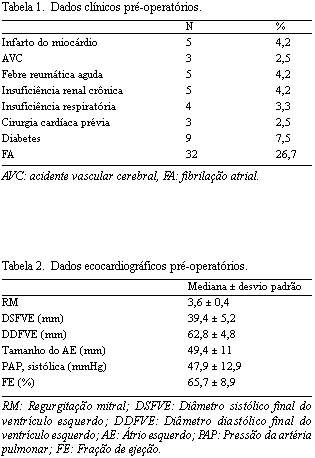
A análise incluiu 120 pacientes consecutivos que foram submetidos ao RMP pelo prolapso da CA, entre 1989 e 2005. Oitenta e sete pacientes eram do sexo masculino e 33 do feminino, sendo a média de idade de 59,1 ± 11,5 anos. Vinte e um (18%) pacientes encontravam-se na classe funcional I da New York Heart Association; 28 (23%), na classe II; 55 (46%), na classe III e 15 (13%), na classe IV. Os dados clínicos pré-operatórios estão apresentados na Tabela 1, enquanto os dados ecocardiográficos estão na Tabela 2. Foram encontrados 37 (30,8%) pacientes com regurgitação tricúspide significante. A doença degenerativa foi a etiologia predominante: Barlow (n=43) e distrofia (n=62). As outras etiologias foram: regurgitação mitral (RM) por endocardite cicatrizada (n=5), doença reumática (n=5), isquêmica (n=4) e congênita (n=1). Procedimentos associados foram realizados em 76 (63,3%) pacientes: 57 (47,5%) anuloplastias tricúspides, 11 (9,2%) revascularizações miocárdicas, quatro (3,3%) trocas da valva aórtica, duas (1,7%) cirurgias de Maze, uma plastia da valva aórtica e uma cirurgia de Yacoub. As indicações para cirurgia foram regurgitação mitral grave e diâmetro sistólico final do ventrículo esquerdo, com ou sem sinais funcionais.
Considerações anatômicas
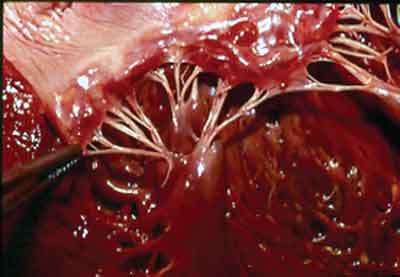
O músculo papilar anterior costuma apresentar dois componentes: anterior e posterior. Em contraste, o músculo papilar posterior costuma apresentar três componentes: anterior, intermediário e posterior (Figura 1). Cordas tendíneas surgindo da cabeça anterior estão ancoradas na cúspide anterior; cordas tendíneas surgindo da cabeça intermediária estão ancoradas na região comissural e aquelas que surgem da cabeça posterior vão para a cúspide posterior. Além disso, a cabeça anterior é sempre mais alta que a posterior. A separação da cabeça anterior da intermediária e da parede ventricular permite a mobilização do músculo em qualquer direção, especialmente para baixo da cavidade ventricular, o quanto for necessário. Portanto, toda cordoalha alongada surgindo da cabeça anterior pode ser reposicionada com a cabeça do músculo papilar sendo direcionada para baixo, desta maneira, corrigindo o prolapso. Com relação à vascularização do músculo papilar, a separação tem que ser vertical.
Técnica operatória
As cirurgias foram realizadas em normotermia, a proteção miocárdica foi ativada com solução cristalóide fria até 1993 e cardioplegia sanguínea fria após esta data. A Tabela 3 sumariza as lesões cirúrgicas da valva mitral encontradas na sistemática avaliação intra-operatória de todos os segmentos. Quando o prolapso envolveu a região posterior da CA (A2/A3) foram realizados RMP posterior e quando envolveu a região anterior (A1/A2), foram realizados RMP anterior. Grande cuidado foi dado à distribuição cordal, para selecionar as cordas tendíneas apropriadas. As técnicas de reparo associadas foram as descritas por Carpentier [1].
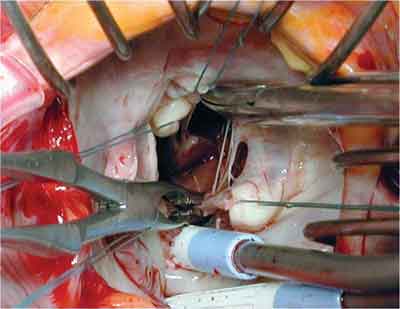
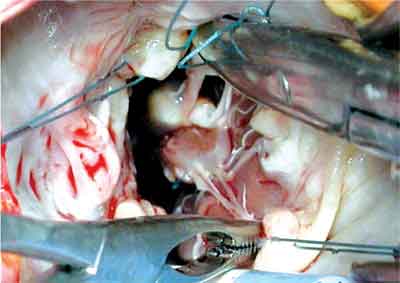
1) O RMP posterior foi realizado com as seguintes manobras: como primeiro passo, a cabeça anterior foi separada extensivamente da intermediária. Em algumas ocasiões, fixações na parede do ventrículo esquerdo foram também ressecadas (Figura 2). Um ponto em U foi, então, suturado na extremidade superior da cabeça, junto à parte fibrosa. O apropriado encurtamento foi alcançado puxando a cabeça anterior para baixo. A importância do prolapso foi determinada precisamente usando dois ganchos: um puxando a borda livre prolapsada da cúspide anterior; o outro puxando a borda livre da cúspide posterior adjacente à cúspide anterior. Esta manobra nos dá a exata altura do prolapso. Conseqüentemente, o deslocamento do músculo papilar iguala a extensão do prolapso previamente mensurado. O ponto previamente fixado na cabeça anterior foi ancorado no tecido fibroso da cabeça posterior ou até mais profundo, dentro da parte muscular da cabeça posterior, se necessário (Figura 3). Em alguns casos, no ponto com pledge, foi usado um pedaço de pericárdio autólogo. A localização apropriada foi determinada pela altura do prolapso.
2) O RMP anterior foi realizado com as seguintes manobras: a cabeça anterior do músculo papilar, composta de cordas tendíneas que vão para A1/A2, foi identificada e separada da cabeça posterior. Então, um ponto em U foi suturado na extremidade mais alta, fibrótica, da cabeça anterior. O ponto foi ancorado para baixo, na cabeça posterior do músculo papilar anterior, levando a borda livre de A1/A2 em direção à parede do ventrículo.
Com exceção de três pacientes, todos receberam uma prótese de anel rígido Carpentier Edwards. As medidas adequadas dos tamanhos dos anéis foram realizadas com uma manobra convencional. A superfície do anel deve ser pelo menos igual à superfície da cúspide anterior [1]. A distância entre as comissuras anterior e posterior deve, também, ser respeitada. O trígono fibroso não deve ser plicado. O tamanho médio do anel mitral foi 32,4 ± 1,5mm. A maioria dos anéis foi tamanho 32 e nenhum paciente recebeu anel menor que 28mm. A combinação de várias técnicas foi necessária para alcançar o reparo em alguns casos. A Tabela 4 sumariza todas as técnicas usadas nesta série de doentes. Pacientes com doença coronariana tiveram as anastomoses distais, assim como as proximais, realizadas depois da plastia da valva. Quando necessária, a correção das valvas aórtica e tricúspide foi realizada depois do reparo da valva mitral. A anuloplastia tricúspide foi realizada somente quando o diâmetro do anel era maior que duas vezes o tamanho normal (= 70mm), independente ao grau da regurgitação [8]. O tamanho médio do anel tricúspide foi 33,5 ± 0,8. O tempo médio de pinçamento aórtico e circulação extracorpórea foram 98,2 ± 22,7min e 124 ± 27,7min, respectivamente.
Acompanhamento e descrição dos dados
Exames ecocardiográficos transesofágicos intra-operatórios foram obtidos em todos os pacientes. Dados clínicos e ecocardiográficos foram realizados em todos os pacientes antes da alta hospitalar, 1 mês e anualmente, após a cirurgia. No ecocardiograma, a regurgitação mitral foi graduada de 1 a 4. O tempo médio de acompanhamento foi de 6,3 anos ± 0,4, o tempo mediano de acompanhamento foi de 5,9 anos (de 0,1 a 15,6 anos). Nosso estudo preencheu todas as regras éticas do Reino Unido.
Análise estatística
Descrição de variáveis contínuas foi expressa como média ± desvio padrão da média ou como mediana com os extremos. Categorias variáveis foram apresentadas como números absolutos de pacientes e porcentagens. A significância estatística de comparação entre dois ou vários grupos foi testada usando teste de Log Rank. Sobrevida foi calculada usando método de Kaplan-Meier. Valor de p menor que 0,05 foi considerado como estatisticamente significante. As análises foram realizadas usando SPSS software (versão 11.5.1, SPSS Inc).
RESULTADOS
Resultados Imediatos
Mortalidade e morbidade pós-operatória
Não houve óbito intra-hospitalar. Oito (6,5%) pacientes necessitaram de reoperação durante a internação: sete drenagens pericárdicas por hemopericárdio e uma reoperação por mediastinite. Houve um acidente vascular cerebral. Não houve movimento anterior sistólico da válvula anterior, nenhum caso de hemólise ou de endocardite infecciosa. Não houve falência da valva mitral e nem reoperação por incompetência da valva.
Resultados ecocardiográficos pós-operatórios
O ecocardiograma transtorácico da alta hospitalar mostrou não haver insuficiência em 98 (81,7%) pacientes, mínima regurgitação em oito (6,5%) e leve regurgitação em 12 (10%). A média de regurgitação mitral foi 0,16 ± 0,16 e a média do gradiente de pressão diastólica através da valva mitral foi de 3,39 ± 1,15mmHg.
Condução e ritmo pós-operatório
Dez (8,3%) pacientes estiveram em bloqueio atrioventricular total necessitando de marca-passo definitivo. Oitenta (66,5%) pacientes estiveram em ritmo sinusal, 30 (25%) em fibrilacão atrial, quatro (3,5%) em ritmo juncional e seis (5%) em ritmo ventricular.
Reultados tardios
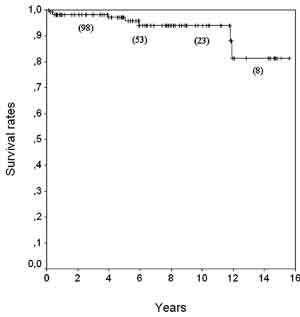
Oitenta e sete (72,5 %) pacientes estavam em classe funcional I da NYHA, 15 (12,5%) em classe funcional II e 3 (2,5%) em classe funcional III. No acompanhamento ecocardiográfico transtorácico, 89 (74,2%) pacientes não apresentaram insuficiência ou insuficiência mínima; oito (6,7%) apresentaram insuficiência leve, enquanto nove (7,5%) mostraram insuficiência moderada. Houve 14 (11,7%) óbitos tardios, incluindo sete (5,8%) por causas cardíacas. Considerando somente estes óbitos por causas cardíacas, as porcentagens de sobrevida acumulada em 1, 5, 10 e 15 anos foram 98,3%, 97,2%, 94,1% e 81,4%, respectivamente (Figura 4). As causas de óbitos relacionadas ao coração foram: falência cardíaca (quatro), embolismo pulmonar (um), edema pulmonar (um) e hemorragia cerebral após troca da valva mitral (um). As outras causas de óbitos foram: acidente vascular cerebral (quatro), septicemia (um), infarto mesentérico (um) e pneumonia (um). Foi necessária reoperação em dois (1,7%) pacientes, os quais tiveram a valva mitral trocada por falência do reparo, 1 e 5 anos depois da plastia. Estes dois pacientes morreram 3 e 6 anos após a troca da valva.
As taxas de sobrevida acumulada livre de reoperação envolvendo a valva mitral em 1, 5, 10 e 15 anos foram 97,4%, 97,4%, 92,8% e 86,7%, respectivamente (Figura 5). Idade (p=0,14), sexo (p=0,43), diabetes (p=0,63), insuficiência renal crônica (p=0,59), etiologia (distrofia ou Barlow) (p=0,45), prolapso do FP associado (p=0,10), ritmo prévio (p=0,06), procedimentos cirúrgicos concomitantes (p=0,87) não foram estatisticamente fatores preditivos para óbito. Assim como, prolapso da CP associado (p=0,51), prolapso comissural posterior (p=0,66), prolapso comissural anterior (p=0,92), descalcificação anular (p=0,59), substituição de corda tendínea (p=0,79) também não foram fatores preditivos para reoperação.
COMENTÁRIOS
Excelentes resultados têm sido obtidos com o reparo da valva mitral evitando a inconveniência da troca por próteses. De fato, a plastia da valva mitral é durável e apresenta uma freqüência muito baixa de eventos valvulares [9-12], devendo ser o procedimento de escolha para o tratamento da insuficiência da valva mitral degenerada. O reparo da cúspide posterior é o mais comum procedimento na plastia da valva mitral [1,13-15]. A ressecção quadrangular associada ou não com "sliding" plastia é a técnica de eleição nesta indicação. A anuloplastia com anel protético para restabelecer a forma do orifício valvar mitral, em todas as doenças crônicas dos casos acima, é aceita pela maioria dos cirurgiões [7]. A tendência é implantar o maior anel possível, já que o implante do anel não é usado para restringir a superfície da valva mitral, mas, sim, para remodelar o orifício [7].
Contudo, ainda existe algum desconforto no que diz respeito ao prolapso da CA, tornando este um desafio cirúrgico. Não existe consenso sobre como se deve reparar o prolapso da CA e ainda surgem publicações questionando a necessidade do reparo desta cúspide[16]. Parece ser importante realçar que a cúspide anterior "billowing" e a cúspide anterior prolapsada não são idênticas. "Billowing" pode ser observado em mais de 70% da população com nenhum grau de regurgitação e, óbvio, "billowing" não requer nenhuma correção. Ao contrário, se presente a regurgitação, existe a necessidade de reparo. Parece correto que 2mm de CA prolapsada podem ser corrigidos com anuloplastia por meio do implante do anel protético, diminuindo o ângulo mitro-aórtico e puxando a borda livre da CA para baixo. Contudo, o prolapso é, com muita freqüência, maior que 2mm, devendo, assim, receber tratamento específico. Em todos os nossos casos, o prolapso da CA foi maior que 2mm.
Nós acreditamos que a plastia da CA pode ser tão fácil e segura quanto a plastia da CP. O primeiro passo é ter um bom conhecimento do aparelho subvalvar, especialmente dos músculos papilares e seus componentes. Na nossa série, o RMP isolado tornou-se a única e mais fácil técnica de reparo do prolapso da CA, qualquer que seja a localização da lesão: A1, A2 ou A3, sendo o reposicionamento muscular sempre a primeira intenção. O RMP pode somente tratar cordas tendíneas alongadas. Quando a cabeça anterior não está realmente individualizada é possível criar uma fenda dentro do músculo papilar entre as cordoalhas anterior e posterior. É importante lembrar que o encurtamento deve ser sempre um pouco menos que o necessário para evitar restrição no movimento da CA. Em alguns casos, a combinação de técnicas é necessária para atingir a completa correção da regurgitação. Limitações podem ser vistas quando nos deparamos com cordas muito alongadas. Em algumas ocasiões nós temos completado o reparo com plicatura da corda tendínea ao nível da sua fixação na cúspide. Em caso de lesões combinadas, como corda alongada e ruptura de corda tendínea, nós temos associado transferência de corda.
Acreditamos que existem várias razões para crer no RMP como método de escolha:
· A transferência (CP para CA) é um excelente método, porém pode ser limitado pelo número de cordas tendíneas disponíveis para tratar uma área extensa de cúspide anterior prolapsada.
· O encurtamento de corda tendínea não é um método direto para reduzir cordas alongadas, porque a efetividade do encurtamento representa metade do comprimento enterrado dentro da fenda criada no músculo papilar. Conseqüentemente, o encurtamento da corda requer experiência no campo de reparo da valva mitral. Ao contrário, o RMP é um encurtamento diretamente relacionado com a reposição e a localização dentro da cavidade ventricular, tem relação igual ao comprimento do prolapso a ser corrigido. Desta maneira, acreditamos que esta técnica seja fácil e segura.
· Além disso, encurtamento de corda tendínea requer grande cuidado para evitar que as suturas fiquem em contato com as cordas manipuladas porque pode levar à ruptura com o tempo. Provavelmente, devido a este detalhe técnico, alguns pesquisadores, como Gillinov et al. [17] relatam a falência do reparo da valva mitral usando a técnica de encurtamento de corda em 22% dos casos, aumentando para 36%, na doença degenerativa, a incidência de insucesso da técnica [18]. Porém, não foi encontrada esta complicação em nossa experiência pessoal, com mais de 400 reparos em valva mitral. A freqüência de falências explica a necessidade de pesquisa em técnicas alternativas.
· RMP pode ser mais útil em caso de prolapso paramediano e paracomissural posterior da CA. Em muitos pacientes, a corda tendínea costuma nascer da ponta do músculo papilar. Desta maneira, o sepultamento torna-se impossível quando existem várias cordas, porque raramente mais de duas cordas podem ser sepultadas dentro da mesma fenda. Nesta circunstância, o RMP oferece uma alternativa segura e elegante. O princípio básico desta técnica é separar a cabeça anterior do músculo papilar posterior, puxando-a separadamente e posicionando para baixo, dentro do ventrículo. Algumas cordas independentes de outras.
· Quando ocorre prolapso paramediano da CA, muito freqüentemente a área comissural posterior não está envolvida. Nestes casos, a separação da cabeça anterior corrige o prolapso localizado, sem interferir com as estruturas adjacentes da cúspide.
· Em muitas situações, o reposicionamento leva apenas um fio de sutura 4.0 monofilamentado atado na área fibrótica da cabeça do músculo papilar. Esta é a mais simples e rápida técnica para correção do prolapso da CA.
· Quando o prolapso da CA ocorre ao nível do músculo papilar anterior, o RMP é também viável. Em muitos casos, existem somente dois componentes, um anterior e outro posterior. Além disso, o RMP posterior pode ser facilmente associado ao RMP anterior. Desta maneira, qualquer área prolapsada da cúspide anterior pode ser tratada, com sucesso, usando esta técnica.
· O prolapso comissural posterior permanece ainda entre as mais desafiantes lesões a serem reparadas. Em nossa série tivemos 16 (13,3%) pacientes com este tipo de lesão associada com prolapso da CA. Separando as cabeças anterior e posterior do componente intermediário, ficamos aptos a encurtar, com diferentes extensões, a cordoalha comissural e a cordoalha paramedial. Recentemente, Aubert et al. [19] descreveram bons resultados tardios no reparo prolapso comissural, porém em 50% dos casos eles fecharam a comissura. Com o RMP nunca nos deparamos com a necessidade de ocluir a comissura, o simples reposicionamento da cabeça intermediária do músculo papilar posterior possibilita a correção do prolapso comissural.
Nós acreditamos fortemente que o RMP mostra melhores resultados que outras técnicas usadas anteriormente, uma vez que nenhuma reoperação por recorrente prolapso da CA foi demonstrada em nosso estudo prévio há 10 anos [6]. Mohty et al. [20] demonstraram, em seu elaborado estudo, que dos 80 aos 90 anos de idade o risco de reoperação da CA cai de 25% para 10%. Existia ainda a diferença de resultados entre CA e CP. Nosso estudo mostra que é possível evitar estas diferenças e diminuir a freqüência de reoperação por regurgitação mitral recorrente. Nós acreditamos que o RMP não requer uma longa curva de aprendizado, sendo uma técnica rápida, que economiza tempo para outras manobras, a fim de tratar completamente o prolapso da CA. David et al. [9] têm declarado que o prolapso de múltiplos segmentos de ambas as cúspides deve ser melhor assistido por troca da valva que por reparo, até que novas abordagens de reconstrução, como o completo encurtamento do tronco do músculo papilar, demonstrem resultados satisfatórios. Apesar de não estarmos propondo o deslocamento total do músculo papilar, nós acreditamos que o deslocamento parcial do músculo papilar pode provar uma segura, durável e reprodutível técnica para corrigir as mais complexas lesões da cúspide anterior, como Doença de Barlow, com ou sem prolapso comissural e doença extensa do tecido valvar.
CONCLUSÃO
Em nossa experiência, reposicionamento dos músculos papilares anterior e posterior são métodos de escolha para tratar o prolapso da cúspide anterior, qualquer que seja a localização da lesão, com excelentes resultados clínicos e ecocardiográficos a longo prazo. Nós recomendamos esta técnica como primeira intenção em todos os casos, sugerindo-a como técnica padrão.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Carpentier A. Cardiac valve surgery: the "French correction". J Thorac Cardiovasc Surg. 1983;86(3):323-37.
2. Akins CW, Hilgenberg AD, Buckely MJ, Vlahakes GJ, Torchiana DF, Daggett WM et al. Mitral valve reconstruction versus replacement for degenerative or ischemic mitral regurgitation. Ann Thorac Surg. 1994;58(3):668-76.
3. David TE, Bos J, Rakowski H. Mitral valve repair by replacement of chordae tendineae with polytetrafluoroethylene sutures. J Thorac Cardiovasc Surg. 1991;101(3):495-501.
4. Phillips MR, Daly RC, Schaff HV, Dearani JA, Mullany CJ, Orszulak TA. Repair of anterior leaflet mitral valve prolapse: chordal replacement versus chordal shortening. Ann Thorac Surg. 2000;69(1):25-9.
5. Lam BK, Gillinov AM, Cosgrove DM. Failed mitral valve repair caused by polypropylene suture. Ann Thorac Surg 2003;76(5):1716-7.
6. Dreyfus G, Al Ayle N, Dubois C, de Lentdecker P. Long term results of mitral valve repair: posterior papillary muscle repositioning versus chordal shortening. Eur J Cardiothorac Surg. 1999;16(1):81-7.
7. Dreyfus GD, Bahrami T, Al Ayle N, Mihealainu S, Dubois C, De Lentdecker P. Repair of anterior leaflet prolapse by papillary muscle repositioning: a new surgical option. Ann Thorac Surg. 2001;71(5):1464-70.
8. Dreyfus GD, Corbi PJ, Chan KM, Bahrami T. Secondary tricuspid regurgitation or dilatation: which should be the criteria for surgical repair? Ann Thorac Surg. 2005;79(1):127-32.
9. David TE, Armstrong S, Sun Z, Daniel L. Late results of mitral valve repair for mitral regurgitation due to degenerative disease. Ann Thorac Surg. 1993;56(1):7-14.
10. Carpentier A, Chauvaud S, Fabiani JN, Deloche A, Relland J, Lessana A et al. Reconstructive surgery of mitral valve incompetence: ten-year appraisal. J Thorac Cardiovasc Surg. 1980;79(3):338-48.
11. Pomerantzeff PMA, Brandão CMA, Faber CN, Fonseca MH, Puig LB, Grinberg M et al. Plástica da valva mitral: resultados aos 17 anos de experiência. Rev Bras Cir Cardiovasc. 1999;14(3):185-90.
12. Murad H, Gomes E, Pinheiro A, Azevedo JA, Sá MPL, Noronha AP et al. Surgical treatment of mitral valve insufficiency by valve repair. Rev Bras Cir Cardiovasc. 2002;17(4):299-306.
13. Deloche A, Jebara VA, Relland JY, Chauvaud S, Fabiani JN, Perier P et al. Valve repair with Carpentier techniques: the second decade. J Thorac Cardiovasc Surg. 1990;99(6):990-1002.
14. Galloway AC, Colvin SB, Baumann FG, Harty S, Spencer FC. Current concepts of mitral valve reconstruction for mitral insufficiency. Circulation. 1988;78(5pt1):1087-98.
15. Galloway AC, Colvin SB, Baumann FG, Grossi EA, Ribakove GH, Harty S et al. A comparison of mitral valve reconstruction with mitral valve replacement: intermediate term result. Ann Thorac Surg. 1989;47(5):655-62.
16. Gillinov AM, Cosgrove DM 3rd, Wahi S, Stewart WJ, Lytle BW, Smedira NG et al. Is anterior leaflet repair always necessary in repair of bileaflet mitral valve prolapse? Ann Thorac Surg. 1999;68(3):820-4.
17. Gillinov AM, Cosgrove DM, Lytle BW, Taylor PC, Stewart RW, McCarthy PM et al. Reoperation for failure of mitral valve repair. J Thorac Cardiovasc Surg. 1997;113(3):467-75.
18. Smedira NG, Selman R, Cosgrove DM, McCarthy PM, Lytle BW, Taylor PC et al. Repair of anterior leaflet prolapse: chordal transfer is superior to chordal shortening. J Thorac Cardiovasc Surg. 1996;112(2):287-92.
19. Aubert S, Barreda T, Acar C, Leprince P, Bonnet N, Ecochard R et al. Mitral valve repair for commissural prolapse: surgical techniques and long term results. Eur J Cardiothorac Surg. 2005;28(3):443-7.
20. Mohty D, Orszulak TA, Schaff HV, Avierinos JF, Tajik JA, Enriquez-Sarano M. Very long-term survival and durability of mitral valve repair for mitral valve prolapse. Circulation. 2001;104(12 suppl 1):I1-17.



 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license