INTRODUÇÃO
Valvas cardíacas humanas são utilizadas como substitutos valvares desde 1962 e apresentam algumas vantagens em relação às próteses convencionais, como o desempenho hemodinâmico fisiológico com fluxo sangüíneo central e laminar, incidência quase nula de tromboembolismo, dispensando o uso de anticoagulantes, e maior resistência a infecções. Essas características resultam em melhor qualidade de vida no pós-operatório, e, em algumas séries, maior sobrevida tardia [1].
Em decorrência da limitada disponibilidade de doadores, da dificuldade em realizar captações seguindo normas de assepsia e da preocupação com a transmissão de doenças infecto-contagiosas, foi necessário desenvolver formas de preservação e estocagem de enxertos de boa qualidade. Os métodos utilizados inicialmente, mais agressivos aos tecidos valvares, como óxido de etileno, irradiação gama, ß-propiolactone, liofilização entre outros, foram logo descontinuados, pois os resultados clínicos demonstraram uma diminuição de sua durabilidade, quando comparados aos enxertos frescos [2-4]. A análise dos resultados tardios com o emprego de homoenxertos frescos gerou o conceito de que a durabilidade estava diretamente relacionada ao grau de viabilidade celular do tecido, na ocasião do implante [5].
Buscando o aperfeiçoamento da preservação tecidual e o aumento da disponibilidade de enxertos para transplantes, foi introduzida a técnica de criopreservação, a partir dos anos setenta [6]. Além da preservação criogênica, essa nova metodologia incluía alguns conceitos novos, como captações feitas com técnicas assépticas mais rigorosas, tempo isquêmico quente reduzido, esterilização em soluções com menores concentrações de antibióticos e o congelamento tecidual programado na presença de crioprotetores. A utilização dessas técnicas possibilitou a preservação otimizada da matriz extracelular, com elevado índice de viabilidade celular, sendo empregada de forma rotineira nos Bancos de Tecidos e considerada, até hoje, como a mais eficiente para o processamento e estocagem de homoenxertos valvares [7,8].
Considerando a alta prevalência de substituições valvares no Brasil, em uma população de baixa condição socioeconômica, sem condições para adequada terapia anticoagulante, o Hospital de Caridade da Irmandade da Santa Casa de Misericórdia de Curitiba estabeleceu, em 1996, o primeiro Banco de Valvas Cardíacas Humanas no Brasil, com o propósito de fornecer, de forma sistemática, homoenxertos valvares criopreservados a qualquer instituição e serviço de cirurgia cardíaca do país [9].
O objetivo deste trabalho foi avaliar, de forma retrospectiva, os dados referentes à captação, processamento, aproveitamento e distribuição dos enxertos nos oito anos iniciais de atividades do BVCHSC.
MÉTODO
Todos os corações recebidos no BVCHSC, entre setembro de 1996 e fevereiro de 2005, foram analisados, retrospectivamente, de forma a possibilitar um estudo sistemático dos órgãos processados. A identificação, seleção inicial e abordagem familiar dos potenciais doadores foram coordenadas pelas Centrais de Notificação, Captação e Distribuição de Órgãos (CNCDO), seguindo as diretrizes nacionais para a captação de órgãos humanos, acrescida de critérios adicionais específicos do BVCHSC. A retirada dos órgãos foi feita por médicos, preferencialmente em centro cirúrgico, e obtidos de doadores de múltiplos órgãos (em morte encefálica), doadores em parada cardíaca ou receptores de transplante cardíaco.
O envio de corações ao BVCHSC foi feito seguindo normas estabelecidas pelo Ministério da Saúde e seu recebimento foi sempre feito pela equipe do BVCHSC.
A retirada de órgãos e tecidos de um doador só foi autorizada após testes de triagem para o diagnóstico de doenças infecto-contagiosas como a-HIV 1 e 2, a-HTLV I e II, HBsAg, a-HBc, a-HCV, VDRL e Chagas. A somatória dos tempos isquêmicos quentes e frios não pôde ultrapassar 48 horas. Até maio de 2001, a idade para aceitação dos órgãos foi desde recém-nascidos até um máximo de 60 anos, para a dissecção de valvas aórticas ou 65 anos, no caso das valvas pulmonares. A partir daquela data, os limites máximos de idade foram reduzidos para 55 anos para valvas aórticas e 60 anos para as pulmonares. Não foram aceitos doadores com doenças infecto-contagiosas ou sistêmicas que pudessem afetar a qualidade do tecido valvar, infecções ativas ou septicemias, doenças malignas (exceto tumores primários do sistema nervoso central), doenças auto-imunes ou uso prolongado de corticoesteróides, morte por causa desconhecida.
O BVCHSC, por meio de protocolo explicativo, sugeriu às equipes captadoras e/ou CNCDO envolvidas na captação de coração para valvas uma forma considerada "ideal" para o acondicionamento e transporte dos órgãos captados, que foi avaliada antes de se iniciar a dissecção e processamento dos enxertos. Só foram aceitos para dissecção órgãos cuja temperatura da solução de transporte fosse inferior a 10°C.
De forma rotineira, foram dissecadas as valvas aórticas e pulmonares. Em alguns casos, foram também aproveitadas as valvas mitrais, as aortas torácicas descendentes, as aortas abdominais e os pericárdios. O processamento dos enxertos foi feito em cabine de fluxo laminar classe 100 (Trox do Brasil, modelo FLV CL I Especial), em condições ideais de antissepsia.
Os diâmetros internos dos anéis das valvas aórticas e pulmonares, bem como os diâmetros internos dos condutos das aortas torácicas descendentes e aortas abdominais foram medidos em milímetros (mm), com o auxílio de velas de Hegar. O comprimento dos condutos foi medido em centímetros (cm), com o auxílio de réguas graduadas.
Os enxertos dissecados foram submetidos à análise macroscópica minuciosa, procurando evidências em suas cúspides, condutos ou miocárdio, que pudessem comprometer o bom funcionamento após o implante e classificados em categoria 0 (descartados), 1(mínimas alterações morfológicas) ou 2 (perfeitos).
Os enxertos cardíacos foram descontaminados em solução nutriente RPMI 1640, com baixas concentrações de antibióticos (240µg/mL de cefoxitina, 120µg/mL de lincomicina, 50µg/mL de vancomicina e 100µg/mL de polimixina B ), por 24-48 horas, a 4°C.
Todos os enxertos processados foram submetidos, individualmente, a testes de esterilidade, buscando evidências de contaminação microbiológica.
O congelamento foi feito com solução de RPMI 1640, 10% de dimetil sulfóxido e 10% de soro fetal bovino em equipamento de criopreservação (Planer, modelo KRYO 10-16 Série III e controller modelo K10-22, Sunbury-on-Thames-U.K.) com velocidade de resfriamento tecidual de -1°C/min até que a temperatura do enxerto chegasse a -80ºC. Ao término do congelamento, os enxertos foram transferidos para congeladores de estocagem (Sanyo, modelo ultra-low temperature freezer -152ºC - MDF-1155ATN ou Custom Biogenic Systems, modelo storage unit S-1500 B, Osaka-Japan) a temperaturas do vapor do nitrogênio líquido (-150ºC).
A distribuição de enxertos aos serviços de cirurgia cardíaca foi feita em equipamentos chamados cryoshipper (marca MVE cryogenics equipment, série AYA03D105, Burnsville-USA), seguindo normas estabelecidas pelo Ministério da Saúde.
Somente pessoas treinadas pelo BVCHSC foram autorizadas a descongelar e diluir a solução crioprotetora dos enxertos criopreservados. O descongelamento foi feito de forma rápida, com soro fisiológico a temperaturas entre 42-50ºC, seguido de diluição gradual do crioprotetor com solução de RPMI 1640 e 10% de soro fetal bovino.
O índice de aproveitamento global foi determinado pela relação entre o número total de enxertos liberados para uso clínico e o número total de enxertos dissecados.
RESULTADOS
Um total de 1059 corações, provenientes de 19 Estados brasileiros e 218 diferentes instituições de saúde, foram recebidos no BVCHSC (Figuras 1 e 2). A análise detalhada do recebimento dos corações por Estado/Ano demonstra oscilações temporais importantes, conforme ilustrado na Figura 3.
Dos órgãos recebidos, 977 (92,3%) eram de doadores em morte encefálica, 44 (4,1%) de doadores em parada cardíaca e 38 (3,6%) de receptores de transplante cardíaco. A equipe do BVCHSC estava disponível para o recebimento dos órgãos enviados em todos os casos e em 99,5% deles os corações chegaram da forma prevista.
Dez (0,9%) corações não foram dissecados por apresentarem sorologias positivas em algum dos testes sorológicos de triagem dos doadores, e 142 (6,7%) enxertos foram processados mas, posteriormente, descartados por sorologia positiva ou faltante. Além disso, 12 (0,6%) enxertos com sorologia negativa foram descartados, pois a excessiva hemodiluição dos doadores impossibilitou análise adequada dos testes sorológicos.
Dois (0,2%) corações não chegaram a ser dissecados e duas (0,1%) valvas foram processadas e, posteriormente, descartadas, por ultrapassarem o tempo de isquemia protocolado pelo BVCHSC e em caso algum houve perda de enxertos por temperatura inadequada da solução de transporte.
Os corações de três doadores e 13 valvas aórticas não foram dissecadas devido a idade do doador estar acima do limite de aceitação protocolada pelo BVCHSC. Além destas, 6 (0,3%) valvas aórticas processadas foram posteriormente descartadas, por ultrapassarem, também, o limite de idade estabelecido.
Houve três (0,3%) casos em que os corações não foram dissecados e 18 (0,9%) enxertos rejeitados por seus doadores apresentarem condições clínicas que comprometiam a qualidade dos tecidos valvares.
O acondicionamento inadequado dos corações foi responsável pelo descarte de três (0,3%) órgãos e cinco (0,2%) enxertos.
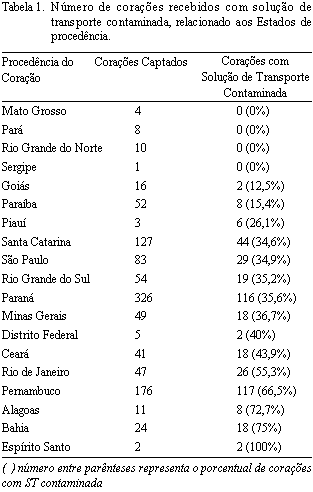
De 922 corações analisados, apenas 177 (19,2%) foram embalados, acondicionados e transportados ao BVCHSC "de forma ideal". Os demais 745 (80,8%) foram acondicionados para o transporte de forma satisfatória, porém sem preencher totalmente as recomendações técnicas sugeridas pelo BVCHSC. Da dissecção dos órgãos embalados "de forma ideal" resultaram 349 enxertos, dos quais apenas 43 (12,3%) estavam com a solução de transporte contaminada, sendo que 39 (90,7%) foram descontaminados. Já nos outros corações, dos 1491 enxertos dissecados, 340 (22,8%) apresentaram contaminação na solução de transporte, sendo que apenas 259 (76,2%) se tornaram descontaminados, após a exposição à solução de antibióticos utilizada. A Tabela 1 correlaciona a procedência dos órgãos contaminados com o Estado de origem.
Dois (0,2%) corações não chegaram a ser dissecados e 18 valvas cardíacas (0,9%) foram descartadas no processamento, por apresentarem lesões, cometidas na retirada dos órgãos, que comprometiam a função valvar.
Dos 1059 corações recebidos, foram processados 2105 enxertos, dos quais 1011 (48%) eram valvas aórticas, 1034 (49%) valvas pulmonares, 32 (1,5%) valvas mitrais, 16 (0,8%) aortas torácicas descendentes, duas (0,1%) aortas abdominais e dez (0,5%) pericárdios. Deste total, 571 (27,1%) enxertos foram rejeitados em alguma fase do processo.
Durante o processamento, 22 (1,0%) enxertos foram descartados por erros técnicos, e houve 12 casos em que as valvas aórticas não foram dissecadas, além daquelas cuja idade do doador ultrapassava o limite estabelecido pelo banco. Em nove desses casos, optou-se pela dissecção da valva mitral, ao invés da aórtica.
O diâmetro interno dos anéis das valvas aórticas liberadas para uso clínico variou de 3,5 a 28mm (20,5 ± 3,4 mm). Os diâmetros mais freqüentemente observados foram de 18 a 24mm (69,6%). Já para as valvas pulmonares, os diâmetros internos variaram de 3,6 a 32mm (23,3 ± 3,6 mm), sendo que 68,8% das valvas situaram-se entre 20 e 26mm.
Após análise macroscópica das cúspides, condutos e tecidos miocárdicos, 138 (13,6%) valvas aórticas e 48 (4,6%) pulmonares foram classificadas como categoria 0 e descartadas. Dos 707 enxertos aórticos liberados, 288 (40,7%) foram considerados perfeitos (categoria 2), enquanto 419 (59,2%) apresentaram mínimas alterações morfológicas (categoria 1), que não afetavam a função valvar. Já para os 773 enxertos pulmonares liberados, 495 (64%) foram classificados na categoria 2 e 278 (36%), na categoria 1. A correlação entre a idade dos doadores e a incidência de descarte por alterações morfológicas dos enxertos está demonstrada na Tabela 2. Chama a atenção o alto grau de rejeição em valvas aórticas de doadores acima de 45-50 anos de idade.
Dos 2105 enxertos processados, 1616 (76,8%) não apresentaram contaminação em nenhuma das etapas do processo e 433 (20,6%) apresentaram contaminação bacteriana e/ou fúngica na solução de transporte. Os germes mais freqüentes foram o Staphilococcus sp, Serratia sp e Escherichia coli. Destes, 330 (76,2%) foram descontaminados após exposição à solução nutriente com baixas concentrações de antibióticos e 103 (23,8%) foram descartados por contaminação persistente. Em 56 (5,3%) casos, a solução de transporte mostrou-se livre de contaminação, porém foi detectada a presença de germes patogênicos em alguma outra etapa do processo.
Foram criopreservados 1913 enxertos, dos quais cinco (0,3%) foram rejeitados por apresentarem curvas de congelamento fora dos padrões estabelecidos pelo BVCHSC.
No período estudado, foram distribuídos 1338 enxertos que foram implantados em 74 instituições de saúde de 17 Estados brasileiros. Destes, 663 (49,5%) foram valvas aórticas, 637 (47,6%) valvas pulmonares, 21(1,6%) valvas mitrais, oito (0,6%) pericárdios, oito (0,6%) aortas torácicas descendentes e uma (0,07%) aorta abdominal. A estratificação anual dos enxertos distribuídos pelo BVCHSC pode ser analisada na Figura 4.
Apesar da utilização progressivamente maior dos homoenxertos nos diversos Estados brasileiros, o Paraná foi responsável por mais da metade dos implantes (Figura 5).
Dos 1338 enxertos utilizados, 458 foram implantados na Santa Casa de Curitiba e, portanto, dispensaram o transporte. Nos demais 880 (65,8%) casos, o transporte foi feito utilizando os equipamentos cryoshipper e em nenhum caso a temperatura dos reservatórios se alterou. Entretanto, atrasos no retorno do cryoshipper foram motivos de perda de sete valvas cardíacas criopreservadas, enviadas como enxertos extras, por expiração da data de validade do transporte estabelecido pelo BVCHSC. Em uma ocasião, ocorreu falha da equipe do BVCHSC, sendo o cryoshipper enviado sem as valvas solicitadas, o que inviabilizou o implante.
O BVCHSC realizou 35 treinamentos, nos quais 175 pessoas tornaram-se aptas a descongelar e diluir o crioprotetor dos enxertos criopreservados. Destas, 66 (37,7%) já realizaram pelo menos um descongelamento e diluição. Um descongelamento foi feito por pessoa não treinada pelo BVCHSC.
De um total de 1331 enxertos descongelados, 38 (2,8%) não foram utilizados na operação pelos seguintes motivos: 16 (42,1%) por mudanças no procedimento cirúrgico, 15 (39,5%) por rachaduras nos condutos, três (7,9%) por óbitos antes do implante, dois (5,3%) por discrepâncias entre a medida nominal do enxerto e aquela observada pelo cirurgião, um (2,6%) por intercorrência durante o descongelamento e um (2,6%) por erro de informação na etiqueta do enxerto criopreservado.
Entre os 1338 enxertos transplantados, foram reportados 71 (5,3%) casos de rachaduras menores nos condutos e outras oito (0,6%) discrepâncias entre a medida nominal do enxerto e aquela observada pelo cirurgião na hora do implante.
Dos 1338 enxertos implantados, 529 foram utilizados para a substituição da valva aortica, 478 para a correção de cardiopatias congênitas, 272 na reconstrução da via de saída do ventrículo direito na operação de Ross, 38 para correção de aneurismas da aorta ascendente com valvopatia aórtica associada e 21 substituições da valva mitral. O índice de aproveitamento global no período estudado foi de 72% e a relação temporal entre o número de enxertos processados, liberados para uso clínico e implantados nos diversos serviços, demonstra um paralelismo entre o número de enxertos liberados para uso clínico com o número de enxertos efetivamente implantados, refletindo uma demanda crescente pelos homoenxertos valvares (Figura 6).
COMENTÁRIOS
O número de corações recebidos anualmente pelo BVCHSC revela aumento gradual e sustentado. Considerando o ano de 2004, quando foram recebidos 202 corações, houve um crescimento de 673% em relação ao ano de 1997, quando esse número foi de apenas 30. Embora esses dados demonstrem avanço significativo no período analisado, o número total de corações recebidos ainda está muito aquém do potencial de captação em nosso país. Isso ficou bem demonstrado quando estratificamos os corações recebidos de acordo com o Estado de origem. Houve oscilações significativas ao longo do tempo, além de desproporções entre o potencial de captação e o número efetivamente captado.
Em nenhum caso, os corações deixaram de ser processados por apresentarem temperaturas inadequadas da solução de transporte e, em somente 0,28% dos corações recebidos, o limite de tempo de isquemia protocolado pelo BVCHSC foi ultrapassado. Com certeza, o fato de 92,3% dos corações serem de doadores de múltiplos órgãos, a presteza do sistema de transporte e a adequada disponibilidade de técnicos do BVCHSC para o pronto processamento dos corações, foram fundamentais para a obtenção desses resultados. Isto demonstra que, apesar das distâncias entre os Estados brasileiros, a regionalização dos bancos de tecidos por motivos relacionados ao transporte não parece justificada.
Ao avaliarmos o porcentual de descarte relatado por diferentes bancos de homoenxertos no mundo, podemos observar que os resultados do BVCHSC (27,1%) foram semelhantes aos encontrados por outros, sendo a morfologia e a contaminação persistente as principais causas de rejeição [10-13]. O índice de rejeição por alterações morfológicas para valvas aórticas e pulmonares, no BVCHSC, foi de 9,1%, sendo os ateromas a principal causa. A análise destes índices, entretanto, é bastante subjetiva, tendo em vista os diferentes critérios de seleção de doadores e controle da qualidade valvar [14]. Observa-se tendência mundial em estabelecer protocolos cada vez mais rígidos para o controle de qualidade dos tecidos, visando o intercâmbio mundial de enxertos. Por isso, cremos que, no futuro, o índice de descarte será ainda maior [15].
A contaminação microbiológica dos tecidos e a efetividade dos métodos empregados para a sua esterilização talvez sejam os aspectos mais complexos e controversos na rotina dos bancos de homoenxertos valvares. Os procedimentos de retirada são feitos em ambientes que variam desde centros cirúrgicos, com condições ideais de anti-sepsia, até necrotérios contaminados [16]. Estas variáveis influem de forma significativa não somente nos índices de contaminação, como também no tipo dos germes envolvidos [17]. O sucesso da descontaminação, que utiliza meio de cultura com baixas concentrações de antibióticos, está relacionado a um baixo nível de contaminação e técnicas de captação estéreis [18]. Em nossa casuística, 76,8% dos enxertos não apresentaram contaminação em qualquer da fase do processamento. Em 20,6% deles, foi possível isolar algum germe na solução de transporte, por ocasião do seu recebimento. Apesar da comparação direta com outros bancos ser bastante difícil, nossos números são semelhantes aos do Banco Europeu de Homoenxertos (EHB), que relatou índice de 25,4% de corações contaminados por ocasião do seu recebimento. Na experiência desses autores, doadores de múltiplos órgãos resultaram em 23,1% de corações contaminados, e este número aumentou para 40,6% quando a captação foi feita em doadores de coração parado [10].
A otimização no processo de captação de órgãos nos parece fundamental para diminuir a contaminação dos tecidos. Dos corações recebidos pelo BVCHSC e que foram embalados e transportados de forma "ideal", a incidência de contaminação foi de apenas 12,3%, sendo que 90,7% destes puderam ser esterilizados. Assim sendo, em 349 enxertos recebidos de forma "ideal", apenas 1,1% foram descartados por contaminação persistente. Nos corações em que o acondicionamento foi diferente do sugerido pelo BVCHSC, 22,8% apresentaram contaminação e apenas 76,2% puderam ser efetivamente descontaminados, ou seja, em 1491 enxertos recebidos fora das condições "ideais", 5,43% foram descartados por contaminação persistente. Isso enfatiza que o aprimoramento em todas as fases de seleção de doadores e captação de órgãos e o adequado treinamento das equipes captadoras é primordial para que os bancos de tecidos possam estabelecer protocolos que resultem em enxertos de alta qualidade.
Assim como os tempos de isquemia, os limites de idade aceitáveis para doadores de valvas cardíacas variam. Alguns bancos de tecidos estabelecem limites máximos de até 75 anos de idade, enquanto outros chegam a diminuí-los para 40 anos, pois associam a idade avançada do doador a um maior risco de degeneração valvar [16,19,20]. Em nossa casuística, chamou a atenção o elevado índice de descarte de valvas aórticas de doadores mais velhos do que 40-50 anos de idade. Por esse motivo, diminuímos o limite de aceitação de valvas aórticas de 60 para 55 anos.
A transmissão de doenças infecto-contagiosas em transplante de tecidos pode ser minimizada pela seleção criteriosa do doador. Isso inclui os testes de triagem para a detecção de doenças transmissíveis, a análise da história médica e social do doador e a observação de evidências físicas que possam sugerir ou indicar doenças que contra-indiquem o uso de seus órgãos ou tecidos [21].
Dentre os tecidos processados no BVCHSC, 97% foram de homoenxertos valvares aórticos e pulmonares, sendo que 69,6% das valvas aórticas tiveram diâmetro interno entre 18-24 mm e 68,8% das pulmonares mediram entre 20-26 mm. Considerando que as doenças valvares aórticas estão freqüentemente associadas à dilatação de seu anel, muitas solicitações de valvas aórticas com diâmetros superiores aos disponíveis são feitas. Assim, é muito importante que os cirurgiões estejam familiarizados com técnicas de redução ou ampliação da raiz aórtica, de forma a compatibilizar a sua dimensão e geometria de acordo com o tamanho do homoenxerto disponível. Falhas na observação desses detalhes podem levar à estenose ou insuficiência valvar [22].
A sistemática de distribuição dos homoenxertos criopreservados pelo BVCHSC foi satisfatória. Conforme observado por Goffin et al. [23], o estreito relacionamento entre o cirurgião responsável pelo implante e a equipe do Banco, auxiliando na escolha do enxerto adequado e nos detalhes para seu transporte, descongelamento e diluição, também nos parece essencial para o desempenho eficaz e satisfatório no processo de distribuição.
O aumento progressivo no uso de homoenxertos criopreservados distribuídos pelo BVCHSC e a diversidade de Estados brasileiros onde estes transplantes foram realizados demonstra o crescente interesse e amplo acesso dos cirurgiões cardiovasculares com este tipo de substituto valvar [24]. O alto índice de implantes realizados no Estado do Paraná, quando comparado a outros Estados, pode ser justificado pelo seu pioneirismo e crescente demanda por enxertos homólogos, em vista dos ótimos resultados obtidos [25,26].
A análise da curva de aproveitamento global demonstrou a importância da disponibilidade dos enxertos no entusiasmo dos cirurgiões em empregá-los. Entre 1998 e 2002, a quantidade crescente de enxertos disponibilizados propiciou aumento significativo dos implantes, entretanto, nos últimos dois anos, a relação entre a oferta e a demanda foi menos favorável. Nossa vivência cotidiana no BVCHSC indica que qualquer dificuldade na disponibilização imediata de um enxerto implica em insatisfação e desestímulo ao seu emprego. Por esse motivo, achamos muito importante a completa integração e contínuo trabalho entre o Banco e as CNCDO, no sentido de ajustar o sistema de captação de forma efetiva.
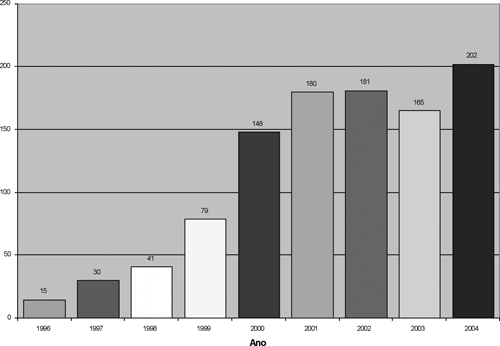
Fig. 1 - Distribuição anual dos corações recebidos no BVCHSC entre setembro de 1996 e Dezembro de 2004
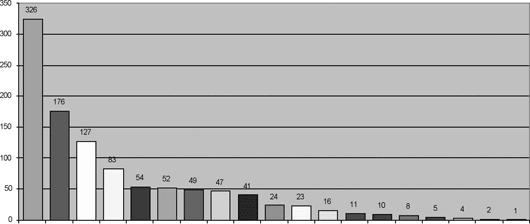
Fig. 2 - Corações recebidos no BVCSH, estratificados por Estado
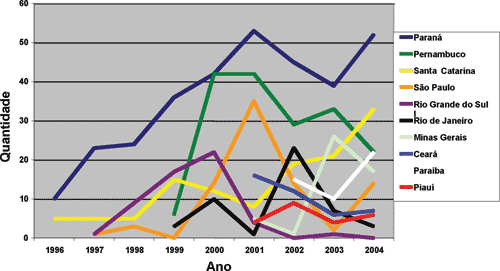
Fig. 3 - Corações recebidos no BVCHSC, estratificados por Estado/Ano

Fig. 4 - Distribuição anual de enxertos entre setembro de 1996 e dezembro de 2004
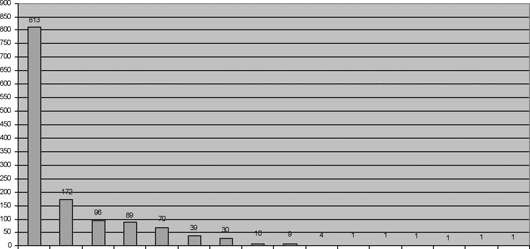
Fig. 5 - Distribuição de enxertos por Estado

Fig. 6 - Relação temporal entre o número de enxertos processados, liverados para uso clínico e implantados

A análise dos resultados dos primeiros oito anos de funcionamento do BVCHSC nos permite concluir que:
1. A captação de corações para o processamento de enxertos cardiovasculares aumentou de forma gradual e significativa no período analisado, sendo Paraná, Pernambuco e Santa Catarina os Estados que mais captaram.
2. O sistema de transporte de órgãos estabelecido entre as companhias aéreas e o Ministério da Saúde, bem como a disponibilidade da equipe do BVCHSC em receber, processar e distribuir os corações recebidos, foram efetivos.
3. As duas principais causas de descarte de enxertos foram contaminação microbiológica persistente (4,89%) e alterações estruturais das valvas dissecadas (13,6% para valvas aórticas e 4,6% para as pulmonares).
4. A perda de enxertos decorrente de erros técnicos das equipes de retirada foram poucas, mostrando não ser necessário treinamento específico para captação de corações para valvas.
5. O índice de contaminação da solução de transporte diminuiu quando o órgão foi acondicionado e transportado da forma sugerida pelo Banco.
6. A solução de esterilização adotada foi eficaz na descontaminação de 76,2% dos corações que apresentaram solução de transporte contaminada.
7. Os treinamentos de técnicos para o descongelamento e diluição da solução crioprotetora dos homoenxertos criopreservados possibilitaram o implante dos mesmos sem a presença da equipe do BVCHSC.
8. Os Estados que mais transplantaram valvas processadas pelo BVCHSC foram Paraná, São Paulo e Rio Grande do Sul.
9. O índice de aproveitamento global dos enxertos dissecados no BVCHSC foi de 72%.
10. As atividades do BVCHSC relacionadas à captação, processamento, armazenamento e distribuição de enxertos homólogos cardiovasculares, durante estes oito anos de funcionamento, foram satisfatórias, atingindo os objetivos propostos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. O'Brien MF, Harrocks S, Stafford EG, Gardner MA, Pohlner PG, Tesar PJ et al. The homograft aortic valve: a 29-year, 99.3% follow up of 1,022 valve replacements. J Heart Valve Dis. 2001;10(3): 334-45.
2. Barratt-Boyes BG. A method for preparing and inserting a homograft aortic valve. Br J Surg. 1965;52(11):847-56.
3. Longmore DB, Lockey E, Ross DN, Pickering BN. The preparation of aortic-valve homografts. Lancet. 1966; 2(7461):463-4.
4. Malm JR, Bowman FO Jr, Harris PD, Kowalik AT. An evaluation of aortic valve homografts sterilized by electron beam energy. J Thorac Cardiovasc Surg. 1967;54(4):471-7.
5. Barratt-Boyes BG, Roche AH, Whitlock RM. Six year review of the results of freehand aortic valve replacement using an antibiotic sterilized homograft valve. Circulation. 1977;55(2):353-61.
6. Angell JD, Christopher BS, Hawtrey O, Angell WM. A fresh viable human heart valve bank: sterilization, sterility testing, and cryogenic preservation. Transplant Proc. 1976;8(2 Suppl 1):139-47.
7. Watts LK, Duffy P, Field RB, Stafford EG, O'Brien MF. Establishment of a viable homograft cardiac valve bank: a rapid method of determining homograft viability. Ann Thorac Surg. 1976;2(3):230-6.
8. O'Brien MF, Stafford EG, Gardner MA, Pohlner PG, McGiffin DC. A comparison of aortic valve replacement with viable crypreserved and fresh allograft valves, with a note on chromosomal studies. J Thorac Cardiovasc Surg. 1987;94(6):812-23.
9. Costa FD, Costa MB, Costa IA, Poffo R, Sardeto EA, Matte E. Clinical experience with heart valve homografts in Brazil. Artif Organs. 2001;25(11):895-900.
10. Goffin YA, Van Hoeck B, Jashari R, Soots G, Kalmar P. Banking of cryopreserved heart valves in Europe: assessment of a 10-year operation in the European Homograft Bank (EHB). J Heart Valve Dis. 2000;9(2):207-14.
11. Raanani E, Groysman M, Erez E, Berman M, Kogan A, Aravot D et al. Establishment of a heart valve homograft bank using existing facilities. Transplant Proc. 2003;35(2):634-5.
12. Verghese S, Padmaja P, Sindhu B, Elizabeth SJ, Lesley N, Cherian KM. Homograft valve bank: our experience in valve banking. Indian Heart J. 2004;56(4):299-306.
13. Jashari R, Van Hoeck B, Tabaku M, Vanderkelen A. Banking of the human heart valves and the arteries at the European Homograft Bank (EHB): overview of a 14-year activity in this international association in Brussels. Cell Tissue Bank. 2004;5(4):239-51.
14. Mestres C-A, Agusti E, Martinez A, Cabrer C, Manyalich M, Cartaña R et al. Cardiovascular tissue banking in the non-cadaveric setting: ten-year experience of a university hospital-based bank with active organ donation program. J Heart Valve Dis. 2000;9(4):523-9.
15. Von Versen R, Mönig H-J, Salai M, Bettin D. Quality issues in tissue banking: quality management systems - a review. Cell Tissue Bank. 2000;1(3):181-92.
16. Lange PL, Hopkins RA. Allograft valve banking: techniques and technology. In: Hopkins RA, ed. Cardiac reconstructions with allograft valves. New York:Springer-Verlag;1989. p.37-63.
17. Gall K, Smith S, Willmette C, Wong M, O'Brien M. Allograft heart valve sterilization: a six-year in-depth analysis of a twenty-five-year experience with low-dose antibiotics. J Thorac Cardiovasc Surg. 1995;110(3):680-7.
18. Strickett MG, Barratt-Boyes BG, MacCulloch D. Disinfection of human heart valve allografts with antibiotics in low concentration. Pathology. 1983;15(4):457-62.
19. O'Brien MF, Stafford EG, Gardner MA, Pohlner PG, McGiffin D, Johnston N et al. The viable cryopreserved allograft aortic valve. J Card Surg. 1987;2(2):153-67.
20. Parker R. An international survey of allograft banks. In: Yankah AC, Yacoub MH, Hetzer R, eds. Cardiac valve allografts: science and practice. Darmstadt:Springer;1997. p.5-9.
21. Eastlund T. Infectious disease transmission through cell, tissue, and organ transplantation: reducing the risk through donor selection. Cell Transplant. 1995;4(5):455-77.
22. O'Brien MF. Allograft aortic root replacement: standardization and simplification of technique. Ann Thorac Surg. 1995;60(2 Suppl.):S92-4.
23. Goffin Y, Grandmougin D, VanHoeck B. Banking cryopreserved heart valves in Europe: assessment of a 5-year operation in an international tissue bank in Brussels. Eur J Cardiothorac Surg 1996; 10: 505-12.
24. Gerola LR, Araújo W, Kin HC, Silva GE, Pereira Filho A, Vargas GF et al. Cryopreserved aortic homograft for aortic valve replacement: immediate results. Arq Bras Cardiol. 2004;83(4):280-3.
25. Costa F, Haggi H, Pinton R, Lenke W, Adam E, Costa IS. Rest and exercise hemodynamics after the Ross procedure: an echocardiographic study. J Card Surg. 1998;13(3):177-85.
26. Costa FDA, Poffo R, Matte E, Sardeto EA, Schneider RA, Adam EP et al. Cinco anos de experiência com a operação de Ross: o que aprendemos? Rev Bras Cir Cardiovasc. 2000;15(2):109-28.








 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license