Heraldo Guedis Lobo Filho; Nestor Lemos Ferreira; Rafael Bezerra de Sousa; Eduardo Rebouças de Carvalho; Patrícia Leal Dantas Lobo; José Glauco Lobo Filho
DOI: 10.5935/1678-9741.20110024
O infarto agudo do miocárdio (IAM), definido como a morte do músculo cardíaco decorrente de isquemia, é um dos diagnósticos mais comuns em pacientes hospitalizados nos países industrializados. Nos EUA, por exemplo, a cada ano observa-se que cerca de 650.000 indivíduos apresentam um primeiro IAM, enquanto 450.000 têm um episódio recorrente [1]. O crescimento acelerado dessa afecção em países em desenvolvimento representa uma das questões de saúde pública mais relevantes da atualidade [2].
Para se estudar possíveis efeitos protetores de drogas sobre a lesão miocárdica decorrente do IAM, um dos modelos experimentais muito utilizado é a indução de IAM por meio da administração de isoproterenol em ratos, uma vez que esta substância causa uma lesão miocárdica semelhante àquela observada em IAM em humanos [3]. Dentre os vários mecanismos propostos para explicar o dano miocárdico induzido pelo isoproterenol, podemos citar: desbalanço entre o suprimento de oxigênio e a demanda dos cardiomiócitos, relacionado à hipotensão no leito coronariano e à hiperatividade miocárdica, pelo aumento do cronotropismo e inotropismo [4]; aumento da sobrecarga de Ca++ intracelular [5]; ativação da enzima adenilatociclase, com depleção dos níveis de ATP [6]; aumento do estresse oxidativo por produtos do metabolismo do isoproterenol e geração de radicais livres [7].
Há, na literatura, uma série de estudos que, utilizando esse modelo, avalia o efeito de diferentes substâncias sobre alterações bioquímicas, de marcadores de estresse oxidativo e histopatológicas decorrentes da lesão miocárdica em ratos [8,9].
O presente estudo tem como objetivo avaliar e validar, em nosso meio, o modelo de IAM induzido por isoproterenol em ratos, haja vista a escassez de publicações científicas com o uso deste modelo no nosso País.
MÉTODOS
Este estudo, cujos dados são oriundos de uma dissertação de mestrado apresentada ao Programa de Pós-Graduação Stricto Sensu em Cirurgia do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará, foi desenvolvido no Laboratório de Cirurgia Experimental da Faculdade de Medicina da Universidade Federal do Ceará.
Aspectos éticos
Os procedimentos experimentais foram realizados de acordo com os padrões éticos estabelecidos pela Comissão de Ética em Pesquisa Animal (CEPA) da Universidade Federal do Ceará, sob o protocolo (69/10). Foram obedecidas as normas estabelecidas pelo Council for International Organization of Medical Sciences (CIOMS) e os preceitos do Colégio Brasileiro de Experimentação Animal (COBEA).
Amostra
Foram utilizados 30 ratos jovens, machos, com peso entre 145 e 230 g (média: 185,12 ± 18,58), da linhagem Wistar, provenientes do Biotério Central da Universidade Federal do Ceará, criados e mantidos sob condições ambientais e alimentares semelhantes.
Ambiente de Experimentação
Os animais foram mantidos em gaiolas de polipropileno, alojadas em dependências refrigeradas (24±2ºC). Observouse a alternância dos ciclos claro/escuro a cada 12 horas. Os ratos foram alimentados com uma dieta industrializada específica para o uso em laboratórios. A água oferecida era potável. A higienização das gaiolas e o exame dos animais foram realizados diariamente pelo técnico responsável e pelo pesquisador, respectivamente. Os animais permaneceram em jejum e sem oferta de água, a partir de 12 horas antecedentes à aplicação da anestesia, a qual precedeu o sacrifício, para coleta de sangue, cujo intuito foi de se realizar hemograma completo e dosagens de ureia, creatinina, TGO, TGP e troponina I, retirar o segmento apical do ventrículo esquerdo para exame histopatológico e fragmentos do ventrículo esquerdo, para avaliação da atividade da catalase e das concentrações de glutationa.
Os ratos foram previamente aclimatados por um período de sete dias anterior à realização dos experimentos. Os procedimentos cirúrgicos foram realizados em ambiente refrigerado, no Laboratório de Cirurgia Experimental do Departamento de Cirurgia da Universidade Federal do Ceará.
Indução do Infarto
Quanto à indução do IAM, realizou-se, no grupo Infarto, administração subcutânea de isoproterenol, numa dose de 150 mg/kg/dia diluída em 2 ml de solução salina, durante dois dias consecutivos, com intervalo de 24 horas entre as aplicações. A falsa indução do IAM, no grupo Simulado, foi realizada por meio da administração subcutânea de 2 ml de solução salina durante dois dias consecutivos, também com um intervalo de 24 horas entre as aplicações.
O cloridrato de isoproterenol foi obtido da empresa Sigma, na forma de frascos contendo, em cada um, um grama do pó do princípio ativo puro. As doses administradas no grupo Infarto foram calculadas baseadas nos pesos dos animais. Para aferição da quantidade exata de isoproterenol (150 mg/kg do animal) foi utilizada uma balança de precisão, sendo composta uma solução com 2 mL de solução salina para administração subcutânea.
Anestesia
Vinte e quatro horas após a última aplicação subcutânea, procedeu-se à anestesia para realização do sacrifício dos animais. A técnica anestésica envolveu o uso de cloridato de cetamina na dose de 50 mg/kg do animal e cloridrato de xilasina na dose de 10 mg/kg do animal, ambas aplicadas por via intraperitoneal.
Obtenção das Amostras
Após adequado plano anestésico, foi realizada uma incisão em T invertido estendendo-se do pescoço ao púbis.
Coleta de sangue
Obteve-se acesso ao retroperitônio, sendo dissecada a aorta abdominal, em sua porção infrarrenal. A coleta do sangue foi então efetuada por meio de uma punção da aorta abdominal com um jelco descartável de número 24 (24 gauge). Com o uso de uma seringa descartável de 5 mL, acoplada ao jelco, foram colhidos 5 mL de sangue. Desse volume, 2 mL foram armazenados em um tubo para realização de hemograma completo e 3 mL em um tubo para as dosagens bioquímicas (ureia, creatinina, TGO, TGP e troponina I). Os tubos, devidamente identificados, foram então postos em um isopor com gelo.
Coleta da região do ápice cardíaco para estudo histopatológico
Após a fase de coleta do sangue, procedeu-se de forma imediata à abertura do tórax e à retirada do coração. O coração foi então lavado com solução salina e a região apical do ventrículo esquerdo foi posta em um frasco, devidamente identificado, contendo solução de formalina a 10% tamponada.
Coleta de fragmentos do miocárdio para mensuração da atividade da enzima catalase e dos níveis de glutationa
Após a fase de retirada do ápice cardíaco, procedeu-se de forma imediata à ressecção de dois fragmentos da musculatura do ventrículo esquerdo. Esses fragmentos foram pesados, em balança de precisão, e colocados, separadamente, no interior de criotubos devidamente identificados, sendo postos em recipiente contendo nitrogênio líquido. Os criotubos foram então armazenados em um freezer numa temperatura de -70º C, até a realização da análise, em um período de até duas semanas.
Avaliação histopatológica
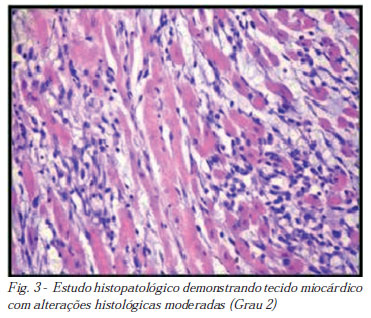
As regiões apicais dos corações, fixadas em solução de formalina a 10% tamponada, foram embebidas em parafina, em um período de cerca de 24 horas após o início da fixação. Cortes medindo quatro micrômetros foram corados com hematoxilina-eosina (HE) e observados microscopicamente. A gravidade e a extensão do IAM foram observadas para cada caso. O patologista não sabia a qual grupo correspondia cada lâmina. Os achados foram classificados nos seguintes graus, para se compor uma escala histológica de lesão miocárdica: (0) Sem alterações; (1) Leve - dano miócito focal ou pequena degeneração multifocal com ligeiro grau de processo inflamatório; (2) Moderado - extensa degeneração miofibrilar e/ou processo inflamatório difuso; (3) Acentuado - necrose com processo inflamatório difuso [10].
Avaliação da atividade da enzima catalase no miocárdio
Vinte µL do homogenato do tecido a 5% em tampão fosfato (50 mM, pH 7) foram adicionados a 2 mL de tampão fosfato de potássio (50 mM, pH 7) contendo H2O2 10 mM. A atividade da catalase foi definida como a quantidade da enzima requerida para decompor 1 nmol de H2O2 por minuto, a 25ºC e pH 7. A absorbância foi lida em espectrofotômetro a 230 nm. Os resultados foram expressos como milimols por minuto por grama de tecido (mmol/min.g tecido) [11].
Avaliação das concentrações de glutationa no miocárdio
O tecido foi homogeneizado com uma solução de EDTA 0,02 M gelado, para preparação do homogenato a 10%. Em seguida, foram adicionados, a uma alíquota de 0,5 mL do homogenato, 0,4 mL de água destilada e 0,1 mL de ácido tricloroacético 50%, e então as amostras foram centrifugadas a 3000 rpm por 15 min. Um volume de 0,5 mL foi então retirado do sobrenadante e adicionados 1 mL de tampão Tris 0,4 M pH 8,9 e 25 ìL de DTNB 0,01 M. A absorbância foi medida dentro de 5 min a 412 nm. A concentração de grupos sulfidrilas não protéicos (NP-SH) foi calculada por meio de uma curva padrão de GSH e os resultados expressos em µg de NPSH/g de tecido [12].
Análise Estatística
A análise estatística foi realizada utilizando o software estatístico SPSS® para Windows (v.16, SPSS Inc. Chicago, IL, USA). As variáveis quantitativas que apresentaram distribuição normal pelo teste de Kolmogorov-Smirnov foram apresentadas por média e desvio padrão. A escala histológica de lesão miocárdica foi a única variável que não apresentou distribuição normal, sendo representada pela mediana e pelo intervalo interquartil.
Para a comparação dos grupos em relação à escala histológica de lesão miocárdica foi utilizado o teste nãoparamétrico de Wilcoxon-Mann-Whitney. O teste t de Student foi realizado para comparação das médias entre os grupos de todas as outras variáveis.
Os resultados foram expressos em forma de tabelas e gráficos, os quais foram elaborados com o software GraphPad® (v.5, GraphPad Software, San Diego, CA).
Em todas as análises, estabeleceu-se 0,05 como probabilidade á do erro tipo I, sendo considerado estatisticamente significante o valor de P < 0,05 (IC 95%).
RESULTADOS
Com relação à taxa de mortalidade, não houve óbitos no grupo Simulado, enquanto a mortalidade no grupo Infarto foi de 25%.
A indução do IAM com isoproterenol causou elevação das contagens de leucócitos e neutrófilos, dos níveis de TGO, troponina I e ureia, reduziu a atividade da catalase e os níveis teciduais de glutationa e causou alterações histopatológicas. Não acarretou alterações nas concentrações de hemoglobina, TGP e creatinina.
Todos os resultados referentes aos parâmetros hematológicos, bioquímicos e do estresse oxidativo encontram-se dispostos nas Tabelas 1, 2 e 3.

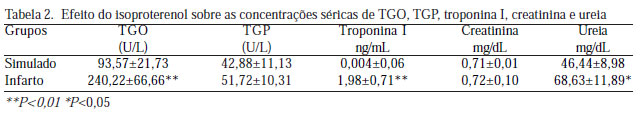

As alterações histopatológicas no miocárdio no grupo Infarto apresentaram maior pontuação na escala histológica de lesão miocárdica em relação ao grupo Simulado, sendo essa diferença estatisticamente significante (P=0,00) (Tabela 4).

As Figuras 1 a 4, geradas por este estudo, apresentam a classificação histológica de lesão miocárdica baseada no estudo de Acikel et al. [10].



DISCUSSÃO
Um modelo amplamente usado para indução de IAM em ratos é o modelo da ligadura coronariana. O coração é exposto através da incisão de toracotomia esquerda e uma ligadura da porção proximal da artéria coronariana é realizada com fio 7-0 [13,14]. Dessa forma, trata-se de um modelo experimental mais complexo, que além da necessidade de toracotomia está associado ao de suporte ventilatório e analgesia pós-operatória. Apresenta maior incidência de eventos de morbimortalidade não relacionados ao IM, como infecção e pneumotórax, alcançando uma mortalidade de cerca de 50% [15].
Considerando-se que estamos iniciando essa linha de pesquisa para se avaliar efeitos protetores de substâncias em situações de injúria miocárdica, adotamos o modelo de indução do IAM por isoproterenol em ratos, dada a sua efetividade, praticidade, reprodutibilidade e menor morbidade e mortalidade dos animais. Esse método é continuamente realizado em estudos internacionais [16,17].
Demonstrou-se que o modelo de IAM induzido por isoproterenol foi adequadamente validado, haja vista que, na comparação entre os grupos Simulado e Infarto, a administração subcutânea de isoproterenol gerou mortalidade, ocasionou aumento dos marcadores de lesão miocárdica TGO e troponina I, aumento das contagens de leucócitos e neutrófilos e das concentrações de ureia, reduziu a atividade da enzima catalase e as concentrações de glutationa no tecido miocárdico e induziu alterações histopatológicas, como processo inflamatório, degeneração miofibrilar e necrose.
Em relação à mortalidade, os dados resultantes do estudo demonstraram uma mortalidade de 25% no grupo Infarto. Esse valor condiz com dados encontrados na literatura, apontando o IAM induzido por isoproterenol como causador de mortalidade nesse modelo experimental. Acikel et al. [10] relataram mortalidade de 33,33% em ratos submetidos a administração de isoproterenol, valor aproximado ao encontrado nessa pesquisa.
Em relação aos parâmetros hematológicos, não houve diferença entre os níveis de hemoglobina na comparação entre os grupos. A influência da administração de isoproterenol sobre os níveis de hemoglobina é pouco citada na literatura. Sangeetha & Quine [18] observaram aumento na contagem total de eritrócitos e concentrações de hemoglobina em ratos submetidos à indução de IAM com isoproterenol.
Observou-se que a administração de isoproterenol causou aumento na contagem de leucócitos e neutrófilos no grupo Infarto, quando comparado ao grupo Simulado. Contagens elevadas de leucócitos e neutrófilos são observadas em ratos com IAM induzido por isoproterenol [18] e são consideradas como situação de risco para o desenvolvimento de IAM [19]. Friedman et al. [20] foram os primeiros a observar a relação entre a contagem de neutrófilos e o subsequente desenvolvimento de IAM. No IAM, neutrófilos podem contribuir para a lesão miocárdica em virtude da liberação de leucotrienos, ERO, e enzimas hidrolíticas. O grau de leucocitose pode estar associado ainda à magnitude da necrose miocárdica [18].
Dados da literatura demonstram que a administração de isoproterenol por via subcutânea tem como consequência um aumento significativo das concentrações séricas de marcadores de lesão miocárdica, como TGO, TGP, CPK, CK-MB, LDH e troponina [10,21,22]. É relatado que os níveis plasmáticos desses marcadores são diretamente proporcionais ao grau de lesões necróticas presentes no miocárdio e, dessa forma, são marcadores de dano miocárdio [10,23]. Estudos prévios demonstraram que kits para dosagem de troponina T e I para humanos podem ser usados em ratos [24,25].
Nesse estudo, a administração de isoproterenol causou aumento das concentrações de TGO e troponina I, quando comparados os grupos Simulado e Infarto, corroborando resultados expressos na literatura. No que concerne à avaliação de marcadores da função renal, constatou-se que o isoproterenol causou elevação das concentrações de ureia. Não foram encontrados na literatura estudos que discorram sobre alterações de marcadores da função renal nesse tipo de modelo experimental. Essa observação pode abrir janelas para a realização de futuras pesquisas acerca de proteção renal em casos de baixo débito cardíaco por IAM. A administração de isoproterenol não causou alterações nas concentrações séricas de creatinina. O aumento significativo dos níveis de ureia sem elevação dos níveis de creatinina em ratos submetidos à indução do IM com isoproterenol indica que o dano renal é de natureza pré-renal, e não de dano renal intrínseco. Esta situação provavelmente está relacionada ao estado de baixo débito cardíaco por disfunção ventricular.
A indução do IAM levou a uma redução da atividade da catalase no tecido miocárdico, como evidenciado na comparação entre os grupos Simulado e Infarto. Esse resultado está de acordo com dados da literatura [26]. Enzimas varredoras de radicais livres, como a catalase, são a primeira linha de defesa contra a lesão oxidativa, decompondo O2 e H2O2 antes de suas interações para formar o radical hidroxila (OH). Durante o IAM, radicais superóxido modulam a atividade da catalase, resultando em redução da atividade dessa enzima e acúmulo de radicais superóxido, com consequente dano ao miocárdio [27].
As concentrações de glutationa no tecido miocárdico reduziram no grupo Infarto em comparação ao grupo Simulado, o que também é observado na literatura [21]. ERO são geradas em estágios precoces do IAM e a glutationa está envolvida na redução de radicais livres peróxidos de hidrogênio, havendo diminuição dos níveis de glutationa nesse período. A glutationa é importante na proteção do miocárdio contra injúria por radicais livres e uma redução de seus níveis pode comprometer a recuperação após períodos de isquemia [28].
A administração de isoproterenol causou alterações histológicas moderadas a acentuadas no grupo Infarto, enquanto se observou ausências de alterações no grupo Simulado, o que também condiz com a literatura [10,21].
Uma das limitações deste estudo foi a não avaliação de dados eletrocardiográficos, variáveis hemodinâmicas e ecocardiográficas, que certamente forneceriam mais informações sobre repercussões da injúria miocárdica. Gelape et al. [29], em seu estudo, avaliaram parâmetros ecocardiográficos e constataram que a medida do volume atrial esquerdo pode ser um bom parâmetro para o diagnóstico de disfunção ventricular em ratos, 1 a 3 semanas pós-IAM.
Desde a década de 1970 até o presente momento, vários trabalhos foram publicados utilizando o modelo de IAM induzido por isoproterenol em ratos, com o intuito de se avaliar os efeitos de diferentes drogas nesse contexto de lesão miocárdica, embora apenas um estudo tenha se desenvolvido no Brasil [30]. Haja vista a praticidade e a efetividade desse modelo, espera-se que o mesmo possa ser mais explorado em nosso meio, sobretudo por pesquisadores relacionados aos temas lesão e proteção miocárdica.
CONCLUSÃO
Com base nos resultados expostos, concluímos que o modelo de IAM induzido por isoproterenol em ratos foi adequadamente reproduzido e validado em nosso laboratório e causou aumento de mortalidade e dos marcadores de lesão miocárdica TGO e troponina I, redução da atividade da catalase e dos níveis de glutationa e alterações histopatológicas.
REFERÊNCIAS
1. Antman EM, Braunwald E, Kasper DL, Fauci AS, Longo DL, Braunwald E, Hauser SL, Jameson JL ST-segment elevation myocardial infarction2005;:1448-59.
2. Whelton PK, Brancati FL, Appel LJ, Klag MJ The challenge of hypertension and atherosclerotic cardiovascular disease in economically developing countries. High Blood Press Cardiovasc Prev. 1995;4:36-45.
3. Ithayarasi AP, Devi CS Effect of alpha-tocopherol on lipid peroxidation in isoproterenol induced myocardial infarction in rats. Indian J Physiol Pharmacol. 1997;41(4):369-76. [MedLine]
4. Yeager JC, Whitehurst ME Verapamil prevents isoproterenolinduced cardiac failure in the rat. Life Sci. 1982;30(3):299-306. [MedLine]
5. Bloom S, Davis DL Calcium as mediator of isoproterenolinduced myocardial necrosis. Am J Pathol. 1972;69(3):459-70. [MedLine]
6. Bhagat B, Sullivan JM, Fischer VW, Nadel EM, Dhalla NS cAMP activity and isoproterenol-induced myocardial injury in rats. Recent Adv Stud Card Struct Metab. 1976;12:465-70.
7. Singal PK, Kapur N, Dhillon KS, Beamish RE, Dhalla NS Role of free radicals in catecholamine-induced cardiomyopathy. Can J Physiol Pharmacol. 1982;60(11):1390-7. [MedLine]
8. Engle SK, Jordan WH, Pritt ML, Chiang AY, Davis MA, Zimmermann JL Qualification of cardiac troponin I concentration in mouse serum using isoproterenol and implementation in pharmacology studies to accelerate drug development. Toxicol Pathol. 2009;37(5):617-28. [MedLine]
9. George JC, Liner A, Hoit BD Isoproterenol-induced myocardial injury : a systematic comparison of subcutaneous versus intraperitoneal delivery in a rat model. Echocardiography. 2010;27(6):716-21. [MedLine]
10. Acikel M, Buyukokuroglu ME, Erdogan F, Aksoy H, Bozkurt E, Senocak H Protective effects of dantrolene against myocardial injury induced by isoproterenol in rats : biochemical and histological findings. Int J Cardiol. 2005;98(3):389-94. [MedLine]
11. Aebi H, Bergmeyer HU Catalase in methods of enzymatic analysis1974;
12. Sedlak J, Lindsay RH Estimation of total, protein-bound, and nonprotein sulfhydryl groups in tissue with Ellman's reagent. Anal Biochem. 1968;25(1):192-205. [MedLine]
13. Brofman PR, Carvalho KA, Guarita-Souza LC, Rebelatto C, Hansen P, Senegaglia AC Transplante celular : análise funcional, imunocitoquímica e histopatológica em modelo experimental de miocardiopatia isquêmica utilizando diferentes células. Rev Bras Cir Cardiovasc. 2004;19(3):261-6. Visualizar artigo
14. Guarita-Souza LC, Carvalho KA, Rebelatto C, Senegaglia AC, Hansen P, Furuta M A comparação entre o transplante de células tronco mononucleares e mesenquimais no infarto do miocárdio. Rev Bras Cir Cardiovasc. 2004;19(3):261-6.
15. Goldman S, Raya TE Rat infarct model of myocardial infarction and heart failure. J Card Fail. 1995;1(2):169-77. [MedLine]
16. Prince PS, Dhanasekar K, Rajakumar S Preventive effects of vanillic acid on lipids, bax, bcl-2 and myocardial infarct size on isoproterenol-induced myocardial infarcted rats : a biochemical and in vitro study. Cardiovasc Toxicol. 2011;11(1):58-66. [MedLine]
17. Thomes P, Rajendran M, Pasanban B, Rengasamy R Cardioprotective activity of Cladosiphon okamuranus fucoidan against isoproterenol induced myocardial infarction in rats. Phytomedicine. 2010;18(1):52-7. [MedLine]
18. Sangeetha T, Quine SD Protective effect of S-allyl cysteine sulphoxide (alliin) on glycoproteins and hematology in isoproterenol induced myocardial infarction in male Wistar rats. J Appl Toxicol. 2008;28(5):710-6. [MedLine]
19. Burr ML, Holliday RM, Fehily AM, Whitehead PJ Hematological prognostic indices after myocardial infarction : evidence from the diet and reinfarction trial (DART). Eur Heart J. 1992;13(2):166-70. [MedLine]
20. Friedman GD, Tekawa I, Grimm RH, Manolio T, Shannon SG, Sidney S The leucocyte count : correlates and relationship to coronary risk factors: the CARDIA study. Int J Epidemiol. 1990;19(4):889-93. [MedLine]
21. Ahmed KK, Rana AC, Dixit VK Effect of Calotropis procera latex on isoproterenol induced myocardial infarction in albino rats. Phytomedicine. 2004;11(4):327-30. [MedLine]
22. Vimal V, Devaki T Linear furanocoumarin protects rat myocardium against lipidperoxidation and membrane damage during experimental myocardial injury. Biomed Pharmacother. 2004;58(6-7):393-400. [MedLine]
23. Geetha A, Sankar R, Marar T, Devi CS Alpha-tocopherol reduces dexorubicin-induced toxicity in rats : histological and biochemical evidences. Indian J Physiol Pharmacol. 1990;34(2):94-100. [MedLine]
24. Chocron S, Alwan K, Toubin G, Kantelip B, Clement F, Kantelip JP Effects of myocardial ischemia on the release of cardiac troponin I in isolated rat hearts. J Thorac Cardiovasc Surg. 1996;112(2):508-13. [MedLine]
25. O'Brien PJ, Dameron GW, Beck ML, Kang YJ, Erickson BK, Di Battista TH Cardiac troponin T is a sensitive, specific biomarker of cardiac injury in laboratory animals. Lab Anim Sci. 1997;47(5):486-95. [MedLine]
26. Sharma M, Kishore K, Gupta SK, Joshi S, Arya DS Cardioprotective potential of ocimum sanctum in isoproterenol induced myocardial infarction in rats. Mol Cell Biochem. 2001;225(1):75-83. [MedLine]
27. Saravanan G, Prakash J Effect of garlic (Allium sativum) on lipid peroxidation in experimental myocardial infarction in rats. J Ethnopharmacol. 2004;94(1):155-8. [MedLine]
28. Stanely Mainzen Prince P, Priscilla H, Devika PT Gallic acid prevents lysosomal damage in isoproterenol induced cardiotoxicity in Wistar rats. Eur J Pharmacol. 2009;615(1-3):139-43. [MedLine]
29. Gelape CL, Sanches MD, Torres RM, Couto CA, Paixão PC, Morales K Análise ecocardiográfica da função diastólica do ventrículo esquerdo após infarto do miocárdio em ratos. Rev Bras Cir Cardiovasc. 2005;20(1):63-8. Visualizar artigo
30. Ribeiro DA, Buttros JB, Oshima CT, Bergamaschi CT, Campos RR Ascorbic acid prevents acute myocardial infarction induced by isoproterenol in rats : role of inducible nitric oxide synthase production. J Mol Histol. 2009;40(2):99-105. [MedLine]
Article receive on quinta-feira, 21 de abril de 2011
 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license