Antonio Alceu dos SantosI,II,III; Alexandre Gonçalves SousaI; Raquel Ferrari PiottoV; Juan Carlos Montano PedrosoIV
DOI: 10.5935/1678-9741.20130083
AVC: Acidente vascular cerebral
CEC: Circulação extracorpórea
CH: Concentrado de hemácia
CRM: Cirurgia de revascularização miocárdica
DM: Diabetes mellitus
DPOC: Doença pulmonar obstrutiva crônica
EuroSCORE: European System for Cardiac Operative Risk Evaluation
FA: Fibrilação atrial
HAS: Hipertensão arterial sistêmica
IC: Insuficiência cardíaca
IR: Insuficiência renal
TGV: Transfusão de glóbulos vermelhos
INTRODUÇÃO
As transfusões de sangue são uma prática médica amplamente utilizada em cirurgia cardíaca, tendo em vista a ocorrência de sangramento excessivo [1]. Em alguns hospitais, a taxa de transfusão de glóbulos vermelhos (TGV) ocorre de modo indiscriminado, chegando a ocorrer em 92,8% dos pacientes operados [2]. Isso tem contribuído para a escassez de hemocomponentes nos bancos de sangue em todo o mundo [3]. No Brasil, essa situação tem ficado cada vez mais crítica, e a tendência é piorar, pois, segundo estudo [4] realizado em 2007, a demanda de sangue no país cresce a taxa de 1% ao ano, enquanto as doações crescem em 0,5% a 0,7% ao ano, indicando assim que, no futuro próximo, teremos que conviver com a possibilidade de não haver sangue disponível para todos os procedimentos médicos.
Na literatura já está fortemente estabelecida a relação entre TGV e maiores complicações clínicas após cirurgia cardíaca, tais como infecções, insuficiência renal (IR), insuficiência cardíaca (IC), fibrilação atrial (FA), acidente vascular cerebral (AVC) [5,6] e câncer [7]. Na última década, vários estudos demonstraram redução da sobrevida após transfusão de concentrados de hemácias (CH) [6,8,9], principalmente, com transfusões maciças [6,10]. Conforme evidenciado em estudo recente, a transfusão de sangue alogênico é um preditor independente de mortalidade precoce e tardia após cirurgia de revascularização miocárdica (CRM) [9]. Essas evidências ajudam a classe médica a adotar uma conduta cada vez mais restritiva em relação à TGV [11,12].
Alguns autores relacionaram essa maior mortalidade com a transfusão de apenas uma unidade de CH, em cirurgia geral [13,14] e em cirurgia cardíaca [6]. Porém, foi publicado, em 2012, o estudo ACUITY [15], demonstrando que a maior mortalidade em pacientes submetidos a CRM se torna significativa somente quando se transfunde quatro ou mais unidades de CH.
Diante desses dados na literatura nacional e internacional, ainda não está bem evidente se o risco de maior mortalidade relacionada à TGV é, realmente, dose-dependente de unidades de hemácias alogênicas transfundidas. O objetivo deste estudo foi avaliar o impacto do número crescente de unidades de CH transfundidas no risco de mortalidade, após um ano, em pacientes submetidos a CRM, em comparação aos pacientes não transfundidos.
MÉTODOS
Foram incluídos prospectivamente em um banco de dados eletrônico, dados de pacientes submetidos ao procedimento de CRM no Hospital Beneficência Portuguesa de São Paulo, com 18 anos de idade ou mais, no período de junho de 2009 a julho de 2010 com seguimento de um ano após a cirurgia. Esse banco contém dados de 3010 pacientes submetidos a CRM, o que contempla 69,6% do total de cirurgias realizadas no período. A ficha de coleta de dados apresenta 243 variáveis com dados coletados de todas as 14 equipes de cirurgia cardíaca da Instituição. Todas as informações foram mantidas em caráter confidencial, assim como a identidade dos pacientes.
Para este estudo, foi realizado um levantamento retrospectivo desse banco de dados. O total da amostra foi de 3004 pacientes, pois seis pacientes não completaram o seguimento de pelo menos um ano. Os pacientes foram divididos em dois grupos: pacientes que não receberam TGV; e pacientes que receberam TGV. Em seguida, subdividimos os pacientes hemotransfundidos em seis grupos: Grupo A; B; C; D; E e F, conforme receberam uma, duas, três, quatro, cinco e seis ou mais unidades de CH, respectivamente, no intra e/ou pós-operatório de cirurgia cardíaca. Após um ano da cirurgia foi calculado o risco de mortalidade (odds ratio) em cada um dos grupos.
Neste estudo foram selecionadas as seguintes variáveis do banco de dados: idade, transfusão, tabagismo, diabetes mellitus (DM), dislipidemia, hipertensão arterial sistêmica (HAS), insuficiência renal, AVC prévio, doença pulmonar obstrutiva crônica (DPOC), insuficiência arterial periférica, doença ce rebrovascular, insuficiência cardíaca, infarto do miocárdio prévio, arritmia, intervenção coronariana, angioplastia coronariana prévia, CRM prévia, cirurgia valvar prévia, cirurgia não cardíaca prévia, cirurgia eletiva ou urgência/emergência, tipo de enxerto (arterial/venoso), uso de circulação extracorpórea (CEC), CRM isolada ou associada a outras cirurgias.
O estudo foi aprovado pelo Comitê de Ética do Hospital Beneficência Portuguesa de São Paulo, sob o parecer de número 136.450.
Análise estatística
Todas as variáveis foram analisadas descritivamente. Para as variáveis quantitativas essa análise foi feita por meio da observação dos valores mínimos e máximos, e do cálculo de médias, desvios padrão e mediana. Para as variáveis qualitativas, calcularam-se frequências absolutas e relativas.
Para obtenção de fatores prognósticos de óbito, foi utilizado o modelo ajustado de regressão logística multivariado [16], contemplando as variáveis que apresentaram na univariada, previamente realizada, P<0,10: idade > 60 anos, tipo de enxerto, CRM isolada, IC, IR, AVC prévio, cirurgia eletiva, arritmia, CRM prévia e cirurgia valvar prévia, DM, infarto do miocárdio prévio, uso de CEC e número de unidades de CH transfundidas.
Por meio do processo de seleção "stepwise", as variáveis selecionadas foram número de unidades de hemácias, CRM isolada, idade, IC, IR, AVC prévio e DPOC. O nível de significância utilizado para os testes foi de 5%.
RESULTADOS
Um total de 4.936 unidades de glóbulos vermelhos foram transfundidos nos 1888 pacientes durante a estadia hospitalar, o que corresponde a 62,8% dos pacientes submetidos a CRM. Destes 1155 (61,2%) pacientes eram do sexo masculino e 733 (38,8%) do sexo feminino. A idade variou de 31 a 89 anos, com desvio padrão de 9,37 anos e mediana de 64,01 anos. Os dados demográficos e características dos pacientes hemotransfundidos avaliados no estudo estão descritos na Tabela 1. O número médio de unidades de hemácias transfundidas por paciente foi de 2,6 ± 2,4 (1-25) unidades. Transfusões de uma, duas e três unidades de CH foram as frequências mais comuns de bolsas de sangue transfundidas: 33,1%, 32,3% e 14,4%, respectivamente. Ou seja, aproximadamente, 80% dos pacientes receberam três ou menos unidades de sangue alogênico (Figura 1). O grupo que não recebeu TGV foi constituído de 1116 pacientes.

A taxa de mortalidade total no grupo de pacientes transfundidos no período de um ano pós-cirurgia foi de 11,2% (212 óbitos), contra apenas 3,3% (37 óbitos) no grupo de pacientes que não receberam transfusão de hemácias. Verificou-se que há um risco crescente de mortalidade nos grupos com o acréscimo de CH alogênicas transfundidas. No grupo que recebeu apenas uma unidade de CH (Grupo A), o risco de mortalidade foi de 4,6% (29 óbitos). No grupo B (2 CH), o risco de mortalidade foi de 6,2% (38 óbitos). O risco de mortalidade no grupo C (3 CH) e no grupo D (4 CH) foi de 12,5% (34 óbitos) e 12,6% (22 óbitos), respectivamente. Com a transfusão de 5 CH (Grupo E) observamos um alto risco de mortalidade, com 22,9% de óbitos (17). O impacto negativo das transfusões de hemácias alogênicas ficou bem evidente no grupo que recebeu 6 ou mais CH (grupo F), onde tivemos 72 óbitos, o que representa a morte de mais da metade (53,3%) dos pacientes desse grupo. O resultado de uma análise do modelo de regressão multivariada confirma que a presença de transfusão de glóbulos vermelhos é um fator preditor independente de mortalidade em CRM, aumentando significativamente o risco de óbito em um ano (OR 2,31; IC 95% 1,33-4,04; P=0,003). A Tabela 2 evidencia as outras variáveis relacionadas à maior mortalidade: idade, AVC prévio, IR, DPOC, IC, insuficiência arterial periférica, tipo de CRM (com outras cirurgias).
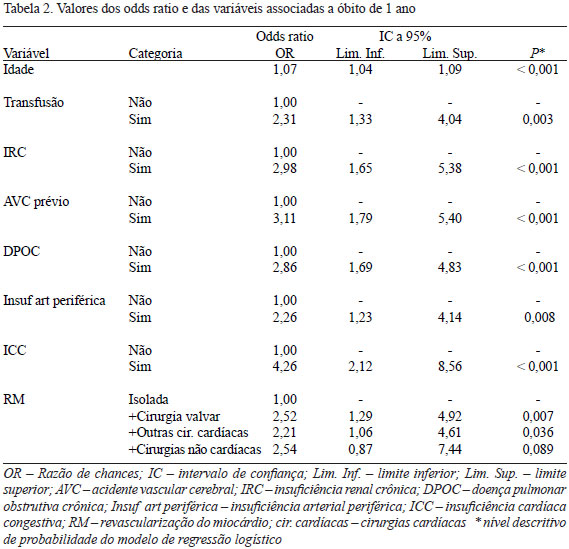
Por meio do modelo de regressão logística foi estimado o odds ratio para cada um dos valores do número de CH transfundidas na análise univariada. O risco de mortalidade aumenta progressivamente conforme a quantidade de unidades de glóbulos vermelhos transfundidos no paciente. Conforme se observa na Figura 2, com apenas uma unidade de CH transfundida, verifica-se um desfecho clínico adverso, com maior risco de ocorrência de óbitos (OR 1,42; P=0,165). No grupo que recebeu duas unidades de glóbulos vermelhos, o risco de mortalidade foi significativamente maior, com odds ratio de 1,94 (P=0,005). A relação entre o risco de mortalidade com o número de bolsas de sangue alogênico transfundido se torna mais evidente nos demais grupos: Grupo C odds ratio de 4,17 (P<0,001); Grupo D odds ratio de 4,22 (P<0,001); Grupo E odds ratio de 8,70 (P<0,001) e, finalmente, no grupo que recebeu seis ou mais unidades de CH temos alto risco de mortalidade com um odds ratio de 33,33 (P<0,001).
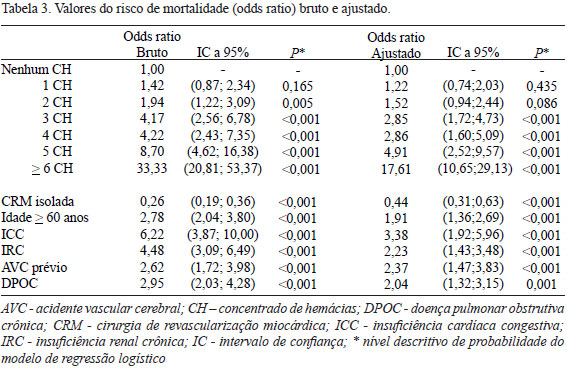
Conforme observamos na Tabela 3, mesmo por meio do modelo ajustado de regressão logística multivariado, o risco de mortalidade também demonstrou ser dose-dependente do número de unidades de CH alogênicas transfundidas. Os valores de odds ratio ajustado aumentam com o acréscimo do número de concentrado de glóbulos vermelhos transfundido. Com uma (grupo A) e duas (grupo B) unidades de CH também se observa maior chance de ocorrências de óbitos, embora não significativa, com odds ratio de 1,22 (P=0,435) e 1,52 (P=0,086), respectivamente. Nos grupos C, D e E, o risco de mortalidade manteve-se crescente, com significância estatística, exemplificado por um odds ratio de 2,85 (P<0,001); 2,86 (P<0,001) e 4,91 (P<0,001), respectivamente. O grupo que recebeu seis ou mais unidade de CH (Grupo F), resultou em alto risco de mortalidade com um odds ratio de 17,61 (P<0,001).
A Figura 3 mostra a curva que estima a probabilidade de ocorrência de óbito por meio do número de unidades de CH transfundidas. Verifica-se que a probabilidade estimada de óbito em um ano da CRM aumenta progressivamente conforme a quantidade de sangue alogênico transfundido, de modo que quando se transfunde oito unidades de CH, a probabilidade de óbito do paciente é de 50%, e na transfusão de 25 unidades de CH a possibilidade de óbito é de 100%.

Neste estudo, o risco de mortalidade demonstrou ser dose-dependente do número de unidades de CH alogênicas transfundidas após a CRM, sendo que, quanto mais unidades de glóbulos vermelhos transfundidos, maior foi o risco de mortalidade no pós-operatório em um ano.
DISCUSSÃO
No mundo, cerca de 85 milhões de unidades de hemácias são transfundidas anualmente, conforme estudo realizado em 2009 [17]. Essa enorme quantidade de sangue utilizado, ainda se deve, entre outros fatores, ao conceito de 1942, quando John Lundy publicou um artigo, sem evidência científica, baseado apenas em sua experiência, que o nível de 10 g/dL de hemoglobina seria o limite mínimo tolerado pelo ser humano, sem risco de morte, para se indicar uma transfusão de sangue alogênico [18]. Essa conduta ainda persiste na comunidade médica. Outro fator que pode explicar a quantidade de hemotransfusões realizadas em nosso estudo (4.936 bolsas de glóbulos vermelhos), é o trabalho realizado em 2001, por DeFoe et al. [19], que em estudo retrospectivo, verificaram que pacientes com anemia (hematócrito abaixo de 22%) durante CRM estavam associados a maior mortalidade operatória. Recentemente, esse último dado foi refutado, sendo demonstrado que, mesmo um hematócrito tão baixo quanto 17% em cirurgia cardíaca, não tem impacto adverso no resultado [12].
Por mais de meio século, tanto em nosso meio, como no mundo, não se questionou a prática transfusional. Engoren et al. [8], em 2002, publicaram um dos primeiros grandes estudos questionando os reais benefícios da terapêutica com os hemocomponentes em cirurgia cardíaca. Os pesquisadores evidenciaram que, mesmo após correções de comorbidades e outros fatores, as transfusões de sangue estão relacionadas com aumento de 70% na mortalidade. Em estudo recente foi demonstrado que a TGV é um preditor independente de mortalidade após CRM em 30 dias (OR 2,00; P=0,007) e em um ano (OR 2,31; P=0,003). Mesmo em pacientes de baixo risco (idade < 60 anos e com EuroScore < 2%), portanto com menos comorbidades, houve significativamente mais óbitos no grupo transfundidos em 30 dias (7% vs. 0%; P<0,001) e também em 1 ano (10% vs. 0%; P<0,001) [9]. Transfusões acima de quatro unidades de CH estão associadas à mortalidade progressivamente maior em cirurgia geral [13] e em cirurgias cardiovasculares [6,10,11,15]. Em um estudo prospectivo, controlado e randomizado ficou evidente o risco crescente de mortalidade com transfusões de 1-2, 3-4, 5-6 e >6 unidades de hemácias, após cirurgia cardíaca [11]. Na literatura, existem outros trabalhos [15,20] que também verificaram desfechos clínicos adversos, pelo efeito de associação de unidades de CH. Este estudo verificou o efeito adverso isolado de cada unidade de CH alogênica transfundida na população de doentes após um ano da CRM.
Em 2006, Koch et al. [6]. ao estudarem mais de 5.000 pacientes hemotransfundidos submetidos a CRM, concluíram que cada unidade de CH administrada aumenta em 77% (OR 1,77; P<0,0001) o risco de mortalidade no pós-operatório, evidenciando uma relação dose-dependente entre a quantidade de CH transfundidas e a redução da sobrevida. Em 2012, Ferraris et al. [14] também demonstraram que há uma dose-resposta de efeitos adversos, inclusive mortalidade, com uso de hemocomponentes em 48.291 pacientes submetidos a cirurgia não cardíaca. Os autores verificaram que os pacientes que receberam apenas uma única unidade de CH (31,4%) apresentaram maior morbimortalidade, mesmo após a utilização de escores de propensão para controlar variáveis de confundimento. De forma similar aos estudos de Koch et al. [6], Stone et al. [15] também encontraram uma relação dose-dependente entre o número de unidades de CH transfundidas e a subsequente mortalidade. Embora não tenham observado evidência de um impacto na sobrevida com a transfusão de três ou menos unidades de CH, Stone et al. [15] afirmaram que não se pode descartar ocorrência de efeito adverso moderado mesmo com a transfusão de uma menor quantidade de sangue.
Os dados do presente estudo corroboram os publicados por Koch et al. [6] e Ferraris et al. [14], demonstrando uma relação direta entre as unidades de hemácias transfundidas e maior risco de ocorrência de óbitos. Além disso, este estudo demonstrou associação entre transfusão de CH e aumento do risco de mortalidade, mesmo com um número menor de unidades de concentrado de glóbulos vermelhos transfundidos, fato não observado por Stone et al. [15], mas encontrado por Koch et al. [6] e Ferraris et al. [14].
Verificou-se que o risco de mortalidade é crescente com o número de unidades de hemácias alogênicas transfundidas. Com a transfusão de apenas uma unidade de CH temos um desfecho clínico adverso, com maior chance de ocorrência de óbito, com odds ratio de 1,42. No entanto, com duas unidades de CH o risco de mortalidade foi significativamente maior, com odds ratio de 1,94. Esse risco de efeito deletério se torna mais significativo, quanto mais unidades de sangue são transfundidas. Com o uso da regressão logística, construímos uma curva (Figura 3) para estimar a probabilidade de ocorrência de óbito através do número de unidades de CH utilizadas. Nota-se que o risco de mortalidade é progressivamente maior conforme o paciente recebe mais bolsas de sangue alogênico.
Os resultados deste estudo evidenciaram que há relação dose-resposta entre o número de CH transfundidas e maior risco de mortalidade, mesmo após correções de comorbidades (Tabela 3). Os valores de odds ratio ajustado aumentam com o acréscimo do número de concentrado de glóbulos vermelhos transfundido, saindo de 1,22 com uma unidade de CH e se eleva progressivamente até 4,91 (P<0,001), com cinco unidades de CH. O grupo que recebeu seis ou mais unidades de hemácias resultou em alto risco de mortalidade, com odds ratio de 17,61 (P<0,001). O fato de não encontrarmos significância estatística nos grupos A e B, pode estar relacionado ao tamanho da amostra de nosso estudo (1.888 pacientes hemotransfundidos). Como mencionado previamente, outros estudos conseguiram demonstrar significância estatística, no risco de mortalidade, com apenas uma unidade de CH, em uma população relativamente maior de pacientes submetidos a transfusão sanguínea [6].
O fato da maioria dos estudos que avaliam o impacto da transfusão de hemácias na evolução dos pacientes em pós-operatórios ser retrospectiva e o conceito de que pacientes mais graves recebem mais sangue alogênico, torna difícil estabelecer uma relação entre causa e efeito. Para estabelecer se um determinado fator e um desfecho clínico é causal ou apenas uma associação, Austin Bradford Hill [21] propôs um conjunto de nove critérios: força de associação, consistência, especificidade, temporalidade, plausibilidade biológica, coerência, evidências experimentais, analogia e dose-resposta. Tais critérios foram empregados para determinar que a relação entre fumo e câncer de pulmão é uma relação causal, uma vez que a realização de um ensaio clínico randomizado não seria ética para essa finalidade.
O mesmo se aplica no caso das transfusões de sangue. Não seria possível realizar um ensaio clínico randomizado, placebo-controlado avaliando os efeitos clínicos da transfusão de unidades crescentes de CH alogênicas. Isto torna a utilização dos critérios de Hill particularmente interessante. Uma análise criteriosa dos critérios de Hill sobre a relação entre transfusão de sangue e desfecho clínico adverso sugere que não se trata apenas de uma associação, e sim de uma relação causa e efeito. Os dados do presente estudo corroboram para essa conclusão.
Vários estudos demonstraram que hemotransfusões resultam em maior risco de morbidades: FA, IR, AVC, IC, infecções e doenças malignas [5-7], consequentemente, essas afecções contribuem para o maior risco de mortalidade precoce e tardia. Os mecanismos exatos em que as transfusões de sangue homólogo levam à morbimortalidade não são plenamente conhecidos e vários caminhos têm sido sugeridos. As hemácias, durante o armazenamento, sofrem uma série de alterações químico-estruturais, tais como depleção de adenosina trifosfato, queda do 2,3-difosfoglicerato (DPG) e perda da elasticidade. Com apenas três horas de estocagem já ocorre queda da bioatividade do óxido nítrico nas hemácias, a qual resultaria na diminuição da oferta de oxigênio na microcirculação e, consequentemente, desfechos clínicos adversos [22].
Outra explicação é a semelhança entre transfusão de sangue e transplante. Segundo Flohé et al. [23], como nos transplantes, as transfusões alogênicas podem resultar em múltiplas reações inflamatórias e imunológicas. Desse modo, quanto mais unidades de CH transfundidas, maior a carga de antígenos injetada na circulação do paciente. Sendo assim, de um lado temos as reações hemolíticas e do outro, mais crítico, a imunomodulação [7]. Portanto, transfusões crescentes de unidades de sangue homólogo podem resultar em risco crescente de mortalidade, como demonstrou este estudo.
Ainda não se conhece qual o limite inferior mínimo de hemoglobina e/ou hematócrito com risco de morte para se recomendar uma hemotransfusão, sem resultar em aumento de efeitos deletérios. Várias estratégias têm sido propostas para se reduzir as transfusões de sangue alogênico. Muitas dessas medidas envolvem otimizar a hematopoiese, minimizar a perda sanguínea em cirurgias e, principalmente, maior tolerância à anemia. Uma estratégia mais restritiva de transfusão de sangue [12] pode ser bem tolerada e não tem impacto adverso na mortalidade. O conhecimento desse fato resultaria em evitar muitas transfusões desnecessárias, visto que, na maioria das vezes, não é o paciente, e sim, o médico que não tolera a anemia. Em outro estudo ficou evidente que uma conduta mais conservadora de transfusão sanguínea, em cirurgia cardíaca com CEC, não altera a taxa de mortalidade entre os grupos de estratégia restritiva (hematócrito >24%) e estratégia liberal (hematócrito >30%) [11]. Já é conhecido que, pacientes com hematócrito abaixo de 40%, necessidade de uso de CEC e múltiplos bypasses têm maior probabilidade de usar sangue em CRM, portanto, identificar, tratar e/ou evitar essas condições resultarão em menor uso de hemocomponentes [20]. Souza & Braile [24] demonstraram que uma hemoconcentração durante a CEC associada a um balanço hídrico reduzido também é capaz de diminuir o uso de sangue e plasma em cirurgia cardíaca. Outras intervenções consistem no uso de antifibrinolíticos, como o ácido épsilon aminocapróico [25], tornar rotina o uso da hemodiluição normovolêmica e reposição total do perfusato [26]. Um estudo realizado em pacientes submetidos a CRM sem o uso de CEC resulta em baixas taxas de complicações pós-operatórias, menor uso de hemoderivados e menor mortalidade [27].
É possível baixar o consumo de sangue, mudando a prática transfusional. Quando se tem o propósito e/ou o desejo multidisciplinar (cirurgião, clínico, anestesiologista e médicos de terapia intensiva) de gerenciar e conservar o sangue autólogo, é possível realizar cirurgias cardíacas complexas, como um retransplante cardíaco, sem o uso de transfusão de sangue alogênico [28]. Centros em todo mundo buscam instituir protocolos para racionar o uso do sangue e tornou-se um critério de qualidade hospitalar perseguido pelas agências certificadoras de qualidade, como por exemplo, a Joint Commission International [29]. Este estudo confirma a importância de se atingir essas metas, buscando opções terapêuticas aos hemocomponenentes.
Há algumas limitações de nosso estudo: estudo retrospectivo de um banco de dados; as hemotransfusões realizadas tanto no intra como no pós-operatório não tiveram um gatilho mínimo de hemoglobina, sendo as transfusões indicadas a critério do médico responsável pelo paciente; o tempo de estocagem das bolsas de sangue transfundidas não foram levados em conta, mas este estudo remete a situação real dos hospitais em nosso meio.
Uma última limitação é que não diferenciamos as transfusões dadas durante e após a cirurgia, uma vez que as transfusões no intraoperatório, especialmente as com CEC, são mais desencadeadas pelos níveis de hemoglobina ou hematócrito e não pelo estado clínico do paciente. Como vantagens, temos: banco de dados eletrônico e preenchido de forma sistemática, bem como, o grande número de pacientes avaliados e a utilização de métodos estatísticos específicos para diminuir a influência de variáveis de confusão.
CONCLUSÃO
O risco de mortalidade é dose-dependente do número de unidades de CH alogênicas transfundida após CRM, sendo que quanto mais unidades de CH transfundidas, maior é o risco de mortalidade no pós-operatório. É preciso reavaliar a prática médica transfusional atual e buscar opções terapêuticas aos hemocomponentes.
REFERÊNCIAS
1. Whitlock R, Crowther MA, Ng HJ. Bleeding in cardiac surgery: its prevention and treatment: an evidence-based review. Crit Care Clin. 2005;21(3):589-610. [MedLine]
2. Bennett-Guerrero E, Zhao Y, O'Brien SM, Ferguson TB Jr, Peterson ED, Gammie JS, et al. Variation in use of blood transfusion in coronary artery bypass graft surgery. JAMA. 2010;304(14):1568-75. [MedLine]
3. Sojka BN, Sojka P. The blood donation experience: self-reported motives and obstacles for donating blood. Vox Sang. 2008;94(1):56-63. [MedLine]
4. Novaretti MCZ. Importância dos carreadores de oxigênio livre de células. Rev Bras Hematol Hemoterapia. 2007;29(4):394-405.
5. Dorneles CC, Bodanese LC, Guaragna JCVC, Macagnan FE, Coelho JC, Borges AP, et al. O impacto da hemotransfusão na morbimortalidade pós-operatória de cirurgias cardíacas. Rev Bras Cir Cardiovasc. 2011;26(2):222-9. [MedLine] Visualizar artigo
6. Koch CG, Li L, Duncan AI, Mihaljevic T, Cosgrove DM, Loop FD, et al. Morbidity and mortality risk associated with red blood cell and blood-component transfusion in isolated coronary artery bypass grafting. Crit Care Med. 2006;34(6):1608-16. [MedLine]
7. Vamvakas EC, Blajchman MA. Transfusion-related immunomodulation (TRIM): an update. Blood Rev. 2007;21(6):327-48. [MedLine]
8. Engoren MC, Habib RH, Zacharias A, Schwann TA, Riordan CJ, Durham SJ. Effect of blood transfusion on long-term survival after cardiac operation. Ann Thorac Surg. 2002;74:1180-6. [MedLine]
9. Santos AA, Sousa AG, Thomé HO, Machado RL, Piotto RF. Impact on early and late mortality after blood transfusion in coronary artery bypass grafting surgery. Rev Bras Cir Cardiovasc. 2013;28(1):1-9. [MedLine]
10. Karkouti K, Yau TM, Rensburg AV, McCluskey SA, Callum J, Wijeysundera DN, et al. The effects of a treatment protocol for cardiac surgical patients with excessive blood loss on clinical outcomes. Vox Sang. 2006;91(2):148-56. [MedLine]
11. Hajjar LA, Vincent JL, Galas FR, Nakamura RE, Silva CM, Santos MH, et al. Transfusion requirements after cardiac surgery: the TRACS randomized controlled trial. JAMA. 2010;304(14):1559-67. [MedLine]
12. Senay S, Toraman F, Karabulut H, Alhan C. Is it the patient or the physician who cannot tolerate anemia? A prospective analysis in 1854 non-transfused coronary artery surgery patients. Perfusion. 2009;24(6):373-80. [MedLine]
13. Bernard AC, Davenport DL, Chang PK, Vaughan TB, Zwischenberger JB. Intraoperative transfusion of 1 U to 2 U packed red blood cells is associated with increased 30-day mortality, surgical-site infection, pneumonia, and sepsis in general surgery patient. J Am Coll Surg. 2009;208(5):931-7.
14. Ferraris VA, Davenport DL, Saha SP, Austin PC, Zwischenberger JB. Surgical outcomes and transfusion of minimal amounts of blood in the operating room. Arch Surg. 2012;147(1):49-55. [MedLine]
15. Stone GW, Clayton TC, Mehran R, Dangas G, Parise H, Fahy M, et al. Impact of major bleeding and blood transfusions after cardiac surgery: analysis from the Acute Catheterization and Urgent Intervention Triage strategY (ACUITY) trial. Am Heart J. 2012;163(3):522-9. [MedLine]
16. Hosmer Jr DW, Lemeshow S. Applied logistic regression. Hoboken:John Wiley & Sons; 1989. 307p.
17. Takei T, Amin NA, Schmid G, Dhingra-Kumar N, Rugg D. Progress in global blood safety for HIV. J Acquir Immune Defic Syndr. 2009;52(Suppl 2):S127-31. [MedLine]
18. Lundy JS. Clinical anesthesia: a manual of clinical anesthesiology. Philadelphia: WB Saunders; 1942.
19. DeFoe GR, Ross CS, Olmstead EM, Surgenor SD, Fillinger MP, Groom RC, et al. Lowest hematocrit on bypass and adverse outcomes associated with coronary artery bypass grafting. Northern New England Cardiovascular Disease Study Group. Ann Thorac Surg. 2001;71(3):769-76. [MedLine]
20. Sá MP, Soares EF, Santos CA, Figueiredo OJ, Lima RO, Rueda FG, et al. Predictors of transfusion of packed red blood cells in coronary artery bypass grafting surgery. Rev Bras Cir Cardiovasc. 2011;26(4):552-8. [MedLine] Visualizar artigo
21. Hill AB. The environment and disease: association or causation? Proc R Soc Med. 1965;58:295-300. [MedLine]
22. Reynolds JD, Ahearn GS, Angelo M, Zhang J, Cobb F, Stamler JS. S-nitrosohemoglobin deficiency: a mechanism for loss of physiological activity in banked blood. Proc Natl Acad Sci U S A. 2007;104(43):17058-62. [MedLine]
23. Flohé S, Kobbe P, Nast-Kolb D. Immunological reactions secondary to blood transfusion. Injury. 2007;38(12):1405-8. [MedLine]
24. Souza DD, Braile DM. Avaliação de nova técnica de hemoconcentração e da necessidade de transfusão de hemoderivados em pacientes submetidos à cirurgia cardíaca com circulação extracorpórea. Rev Bras Cir Cardiovasc. 2004;19(3):287-94. Visualizar artigo
25. Benfatti RA, Carli AF, Silva GVR, Dias AEMAS, Goldiano JA, Pontes JCDV. Influência do ácido épsilon aminocapróico no sangramento e na hemotransfusão pós-operatória em cirurgia valvar mitral. Rev Bras Cir Cardiovasc. 2010;25(4):510-5. [MedLine] Visualizar artigo
26. Souza HJB, Moitinho RF. Estratégias para redução do uso de hemoderivados em cirurgia cardiovascular. Rev Bras Cir Cardiovasc. 2008;23(1):53-9. [MedLine] Visualizar artigo
27. Lima R, Diniz R, Césio A, Vasconcelos F, Gesteira M, Menezes A, et al. Revascularização miocárdica em pacientes octogenários: estudo retrospectivo e comparativo entre pacientes operados com e sem circulação extracorpórea. Rev Bras Cir Cardiovasc. 2005;20(1):8-13. Visualizar artigo
28. Santos AA, Silva JP, Fonseca L, Baumgratz JF. Retransplante cardíaco em criança sem o uso de hemoderivados. Rev Bras Cir Cardiovasc. 2012;27(2):327-30. [MedLine] Visualizar artigo
29. Kumar A. Perioperative management of anemia: limits of blood transfusion and alternatives to it. Cleve Clin J Med. 2009;76(Suppl 4): S112-8. [MedLine]
Não houve suporte financeiro.
Papéis & responsabilidades dos autores
AAS: Pesquisa bibliográfica; levantamento no banco de dados; análise estatística; análise dos resultados; confecção do manuscrito; revisão do manuscrito
AGS: Levantamento no banco de dados; análise dos resultados; correção do manuscrito
RFP: Análise estatística; revisão do manuscrito
JCMP: Pesquisa bibliográfica; análise dos resultados; correção e revisão do manuscrito
Article receive on domingo, 1 de setembro de 2013
 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license