OBJETIVO: Este estudo avalia o comportamento biológico dos heteroenxertos porcinos descelularizados (Grupo Desc) comparados com os homoenxertos criopreservados (Grupo Crio) implantados em carneiros jovens. MÉTODOS: Foram implantados em cinco animais heteroenxertos pulmonares porcinos descelularizados e em outros cinco, homoenxertos pulmonares criopreservados. Os animais apresentaram seguimento médio de 280 ± 14 dias. O diâmetro valvar foi medido por ecocardiografia, a qual foi realizada no 30º pós-operatório e antes do explante. As valvas foram também avaliadas macroscopicamente. A avaliação histológica foi realizada utilizando-se coloração de H.E., Gomori e Weigert e imunohistoquímica (Fator VIII, CD3, Vimentina e CD68). A quantificação de cálcio foi realizada utilizando-se espectrometria de absorção atômica. RESULTADOS: Houve um óbito no Grupo Desc por endocardite. As valvas do Grupo Crio apresentaram decréscimo na celularidade, enquanto que as valvas do Grupo Desc demonstraram repovoamento da matriz com células endoteliais e intersticiais. No grupo Crio, observou-se perda na densidade e desarranjo da arquitetura das fibras colágenas. A espectrometria de absorção atômica demonstrou maior calcificação no conduto e nas cúspides dos enxertos criopreservados quando comparados aos descelularizados (P=0,016). O diâmetro médio valvar no explante foi significantemente maior no Grupo Desc (P=0,025). CONCLUSÃO: Heteroenxertos descelularizados apresentam um comportamento biológico diferente quando comparados aos homoenxertos criopreservados, tornando-se repovoados por células com características de fibroblastos e células endoteliais. A matriz permaneceu bem preservada, o que possibilitou um processo de regeneração celular.
OBJECTIVES: The aim of this study is to assess the biological behaviour of porcine decellularized heterografts (Desc group) compared with cryopreserved homografts (Crio group) implanted in juvenile sheep. METHODS: Decellularized porcine pulmonary heterografts were implanted in five animals and cryopreserved pulmonary homografts in another five. The animals were followed-up for a mean of 280 ± 14 days. The valve diameter was measured by echocardiography, which was performed at the 30th postoperative day, and before the explantation. The valves were also assessed macroscopically. Histological evaluation was performed using H.E., Gomori and Weigert staining. Immunohistochemistry specified different cell types (Factor VIII, CD3, Vimentin and CD68). Calcium quantity was analyzed using atomic absortion spectometry. RESULTS: There was one death in the Desc group due to endocarditis. The valves of Crio group showed decrease in the cellularity whereas the valves of Desc group showed matrix repopulation with endothelial and interstitial cells. Loss of collagen density and disarrangement of the normal fiber architecture was observed in Crio group. Calcium content demonstrated higher levels on the cusps and conduits in Crio group comparatively with Desc group. (P=0.016). The mean valvular diameter at the explantation was significantly increased (P=0.025) in the Desc group. CONCLUSIONS: Decellularized heterografts had a different biological behaviour when compared to cryopreserved homografts and become repopulated by cells with fibroblasts and endothelial cells characteristics. The matrix was preserved and some regenerative potential was present
INTRODUÇÃO
Os enxertos criopreservados são utilizados frequentemente para tratar diferentes tipos de valvopatias e várias formas de cardiopatias congênitas complexas. Nesses casos os homoenxertos apresentam melhor perfil hemodinâmico, baixa incidência de tromboembolismo e maior resistência a infecções, no entanto, a sua durabilidade é limitada, especialmente em crianças e pacientes jovens [1]. Há evidências de que a falência dos homoenxertos é causada, pelo menos em parte, por reações imunológicas provocadas pelos elementos celulares remanescentes na matriz do homoenxerto, os quais despertam reação imunológica por parte do receptor. As células endoteliais e fibroblastos presentes no homoenxerto são capazes de expressar complexos de histocompatibilidade classe I e II, os quais são reconhecidos pelo sistema imunológico do receptor e podem causar degeneração do tecido e falência do enxerto [2].
A descelularização de matrizes homólogas ou heterólogas são técnicas promissoras para evitar a falência do enxerto induzida pela resposta imunológica. Recentes estudos sugerem que heteroenxertos descelularizados induzem a uma resposta inflamatória diminuída por parte do receptor e são capazes de progressivamente serem repovoadas por células autólogas. Esses fatores possibilitam, pelo menos em teoria, melhorar a sobrevida tardia dos enxertos implantados [3-5].
Diferentes métodos de descelularização foram propostos, entre eles, o uso de detergentes como Triton X-100, dodecil sulfato de sódio e o deoxicolato de sódio, entre outros. O principal objetivo da descelularização é remover todos os componentes celulares, mantendo intactos os principais elementos estruturais da matriz extracelular. A manutenção da integridade da matriz colágena é importante para oferecer um apropriado ambiente para a migração celular e ativar a reorganização do tecido [6,7]. Estudos prévios indicam que o processo de remodelamento da matriz extracelular está diretamente relacionado à capacidade regenerativa e ao potencial de crescimento valvar [8].
O objetivo do presente estudo é analisar o comportamento biológico e o potencial de crescimento dos heteroenxertos pulmonares porcinos descelularizados com deoxicolato de sódio e etanol comparados com homoenxertos criopreservados convencionais implantados na via de saída do ventrículo direito de carneiros jovens.
MÉTODOS
Este trabalho consiste no estudo comparativo de homoenxertos criopreservados e heteroenxertos descelularizados implantados em posição ortotópica na via de saída do ventrículo direito de carneiros, por meio de circulação extracorpórea. Foram selecionados dez carneiros jovens com idade entre 14 a 18 semanas (16,6
+ 1,1) e peso entre 33 e 41kg (37,1
+ 2,5), os quais foram divididos em dois grupos de cinco animais, de acordo com o tipo de valva implantada. O primeiro Grupo (Grupo Desc) consistiu de cinco animais, os quais receberam homoenxertos descelularizados, e no segundo Grupo (Grupo Crio) foram implantados homoenxertos criopreservados. Os animais foram acompanhados clinicamente e por meio de ecocardiografia e as valvas explantadas após um período médio de seguimento de 280 dias. O estudo experimental desenvolvido foi aprovado pelo comitê de Ética em Pesquisa com Animais PUC-PR, com protocolo de pesquisa nº 913/03.
Heteroenxertos porcinos descelularizados
Os heteroenxertos foram colhidos de suínos jovens com peso entre 25 e 30 kg. Os corações foram obtidos de forma asséptica e os condutos pulmonares foram dissecados em fluxo laminar, mantendo-se um pequeno segmento de miocárdio subvalvar. O diâmetro interno dos condutos pulmonares foi aferido com vela de Hegar e as valvas com 17 mm de diâmetro foram selecionadas. As valvas foram então conservadas em solução de Hanks (Sigma Chemical, St. Louis, MO, USA) com antibiótico (penicilina 100U/ml
-1, estreptomicina 100µg/mL
-1 e anfotericina B 250ng/mL
-1) a 4ºC, entre 5 a 7 dias, para assegurar a esterilidade dos enxertos. A descelularização das valvas pulmonares porcinas foi realizada utilizando-se deoxicolato de sódio 1%, por 24h, sob contínua agitação, e etanol a 70%, por 30 minutos (Auto Tissue
GmbH). As valvas foram então estocadas em meio Roswell Park Memorial Institute (RPMI 1640, Sigma) até a data do implante.
Homoenxertos criopreservados
Os homoenxertos criopreservados foram colhidos de carneiros jovens com peso entre 25 e 30 kg. Os corações foram obtidos e dissecados nas mesmas condições descritas anteriormente e cinco valvas com diâmetro interno de 17mm foram selecionadas. As valvas foram estocadas em meio de Hanks (Sigma Chemical, St. Louis, MO, USA) com a mesma solução de antibióticos descrita anteriormente, por 48h. Em seguida, as valvas foram lavadas em solução salina a 0,9% e conservadas em meio RPMI com dimetilsulfóxido 10% (Gibco® cód:102270-106) e criopreservadas em freezer de congelamento programado (Planer III, KRYO 10 series) com gradiente de congelamento de -1ºC/min até -80º. As valvas foram então estocadas à temperatura de -150ºC em freezer de armazenamento mecânico (Sanyo, Ultra-low temperature).
O descongelamento das valvas antes do implante foi feito com solução salina 0,9% a 42-50º C, usando diluição gradual de RPMI e soro bovino fetal (10%).
Técnica operatória
Todos os animais receberam valium (Diazepan®, Nova química-Sigma Pharma) 0,5mg/kg intravenoso como medicação pré-anestésica. Em seguida, foi realizada monitorização cardíaca e monitorização de pressão invasiva, procedeu-se à indução anestésica com 4mg/kg de propofol (Diprivan®, Aztra Zeneca) e a manutenção anestésica com propofol a 0,6mg/kg/min. A ventilação mecânica foi realizada em respirador a volume Oxigel 1722 (Oxigel Mats. Hosps. Ind. e Com. Ltda).
Os animais foram posicionados em decúbito lateral direito e sob condições estéreis foi realizada toracotomia lateral esquerda, exposição do pericárdio e heparinização plena com dose intravenosa de 250U/kg. Após, o átrio direito e a aorta torácica descendente foram canulados e instituída circulação extracorpórea normotérmica com a aorta aberta. O tronco da artéria pulmonar foi transseccionado e as cúspides nativas foram removidas. Os enxertos foram então implantados de modo ortotópico, realizando linha de sutura proximal e distal com prolene 4-0. A circulação extracorpórea foi então descontinuada e após adequada hemostasia o tórax foi fechado por planos. O dreno torácico foi removido uma hora após o procedimento.
Após o procedimento cirúrgico, os animais foram encaminhados para o Hospital Veterinário PUC-PR. Foi utilizado como agente analgésico flumexil meglumine (Banamine®, Shering Plough) 1,5mg/kg. Como profilaxia antibiótica utilizou-se Ceftiofur (Ceftiofur Exenel®, Pfizer) 1mg/kg e gentamicina (Gentamicina® Neo-química) 4mg/kg de 12/12h por um período de 5 dias. Ecocardiografia transtorácica de controle (Philips SONOS 5500 System) foi realizada no 30º pós-operatório e antes do explante em todos os casos. O gradiente transvalvar pulmonar e o diâmetro sistólico em corte longitudinal da artéria pulmonar foram obtidos. A ecocardiografia também foi utilizada para estimar a função valvar, mobilidade e espessamento das cúspides.
Explante valvar e análise
Os animais foram sacrificados nove meses após a cirurgia. Os procedimentos foram realizados utilizando anestesia geral e sob condições assépticas. As valvas foram ressecadas incluindo a porção muscular distal da via de saída do ventrículo direito e um segmento distal da artéria pulmonar nativa.
A análise macroscópica foi realizada no momento do explante para detecção de trombo, ruptura valvar ou calcificação. Após, cada enxerto foi dividido longitudinalmente em três segmentos ao longo de suas comissuras, cada um contendo uma cúspide e um segmento de parede valvar correspondente. O primeiro segmento foi enviado para análise de cálcio e os outros dois para análise histológica e imunohistoquímica.
Foi realizada espectrometria de absorção atômica para quantificar o conteúdo de cálcio nas valvas. Os espécimes removidos do conduto e da cúspide foram liofilizados, pulverizados e separados em amostras de mesmo peso. Após, foi realizada hidrólise em HCl 6N por 8h. O conteúdo de cálcio foi medido por absorção atômica (PERKIN ELMER, 4100).
Para análise microscópica os espécimes valvares foram divididos longitudinalmente no meio da cúspide pulmonar e após foram embebidos em parafina. Segmentos de 4 µ de espessura foram corados com hematoxilina e eosina (HE) para caracterização da distribuição celular, também submetidos a coloração de Weigert para análise das fibras elásticas e Gomori para avaliar fibras colágenas.
Os estudos imunohistoquímicos incluíram coloração com fator VIII (Dako-cod. 0082) para identificação de células endoteliais, CD3 para caracterização de linfócitos T (Dako-cod. A0452) e CD68 (Dako-cod. M0725) para detecção de células intersticiais mesenquimais.
Análise estatística
A comparação do conteúdo de cálcio, do diâmetro valvar e do gradiente valvar médio entre os dois grupos foi realizada pelo teste de Mann-Whitney, utilizado para análise de valores não-paramétricos. Considerou-se valor de P
< 0,05 como sendo estatisticamente significativo.
RESULTADOS
Todos os animais sobreviveram à cirurgia e apresentaram boa evolução no pós-operatório imediato. Houve um óbito tardio no Grupo Desc no 40o dia após o procedimento em decorrência de endocardite. Todos os animais remanescentes apresentaram evolução clínica satisfatória até o período do explante. As valvas nos dois grupos foram explantadas após um tempo médio de 280
+ 14 dias. No Grupo Crio, o peso médio pós-operatório aumentou de 36
+ 2,7 kg para 62,7
+ 3,3 kg no momento do explante. No Grupo Desc, o peso médio pré-operatório foi de 38
+ 2,23 kg e no explante, de 60,2 + 2,58 kg.
Morfologia macroscópica valvar
A inspeção morfológica macroscópica das valvas nos dois grupos não demonstrou evidência de trombo ou ruptura. Calcificação ao nível da linha de sutura estava presente em todas as valvas nos dois grupos. No Grupo Crio, dois condutos apresentavam pontos focais de calcificação e outro conduto apresentava calcificação grosseira. No Grupo Desc apenas um conduto apresentou pontos focais de calcificação.
Apesar de não ser observada calcificação nas cúspides nos dois grupos, as cúspides no Grupo Crio estavam mais espessadas (Figura 1), quando comparadas com as do Grupo Desc (Figura 2), no entanto, sem sinais de deformação, retração ou ruptura.
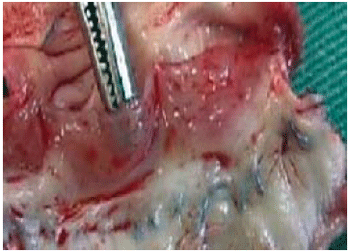
Fig. 1 - Análise macroscópica da cúspide do homoenxerto criopreservado. Foto demonstrando espessamento da cúspide do homoenxerto criopreservado explantado com 9 meses
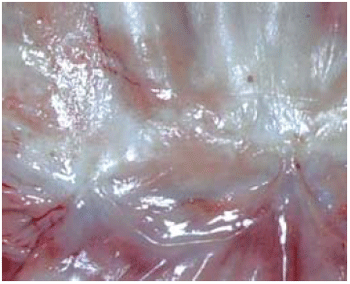
Fig. 2 - Análise macroscópica da cúspide do heteroenxerto descelularizado. Foto demonstrando ausência de espessamento da cúspide do heteroenxerto descelularizado explantado com 9 meses
Homoenxertos criopreservados (Grupo Crio)
Condutos
A microscopia eletrônica evidenciou perda de celularidade e da estrutura trilaminar valvar do conduto pulmonar, não sendo identificada membrana basal. As fibras colágenas e elásticas apresentavam-se fragmentadas e com calcificação focal (Figura 3). Áreas multifocais de necrose e calcificação foram observadas na camada média da parede valvar.
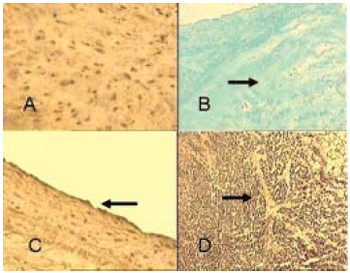
Fig. 3 - Análise histológica por microscopia ótica dos enxertos criopreservados. Fotomicrografias de corte histológico de conduto pulmonar, heteroenxerto descelularizado, aumento 40x. A: imunohistoquímica para Vimentina, observa-se presença de células com características de fibroblastos. B: coloração de Gomori demonstra fibras colágenas íntegras. C: imunohistoquímica para fator VIII, evidenciando-se células endoteliais. D: coloração de Weigert, observa-se a presença de fibras elásticas íntegras
Havia predominância de células inflamatórias na camada adventícia do conduto próximo à linha de sutura, na interface doador-receptor. Este infiltrado inflamatório era predominantemente linfocitário (CD3+) com relação de célula por micrômetro quadrado de 13,81
+ 4,80, localizando-se principalmente na adventícia, estendendo-se até a camada média. Identificaram-se também macrófagos e monócitos por meio de marcador específico CD68 na proporção de 3,00
+ 1,53 céls/µm
2 e não foram identificadas células intersticiais com características para fibroblastos (Figura 3). As valvas apresentavam camada endotelial em sua superfície, de forma não homogênea, caracterizada pela imunomarcação para Fator VIII (Figura 3). A distribuição das células endoteliais na superfície valvar foi de 1,39
+ 1,06 cels/µm
2.
Cúspide
A microscopia eletrônica evidenciou alteração da arquitetura normal das fibras colágenas, com dano estrutural e ruptura das fibras. As fibras elásticas apresentavam-se fragmentadas e sem a arquitetura laminar habitual. Observou-se, também, perda da estrutura trilaminar da cúspide.
As cúspides apresentavam redução importante da celularidade pela coloração com H&E. O interstício apresentava poucas células mesenquimais com morfologia para fibroblastos, na proporção de 0,20
+ 0,07céls/µm
2 e presença de células inflamatórias positivas para CD3, na proporção de 4,34
+ 1,51cels/µm
2. Foram observadas, por meio de Fator VIII, células endoteliais com distribuição focal na proporção de 0,72 + 0,42 cels/µm
2.
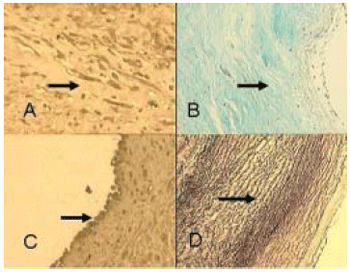
Fig. 4 - Análise histológica por microscopia ótica dos enxertos descelularizados. Fotomicrografias de corte histológico de conduto pulmonar, homoenxerto criopreservado, aumento 40x. A: imunohistoquímica para Vimentina, ausência de células intersticiais com características para fibroblastos. B: coloração de Gomori demonstra degeneração das fibras colágenas. C: imunohistoquímica para fator VIII, observam-se células endoteliais. D: coloração de Weigert com presença de fibras elásticas rotas
Conduto
A camada média da valva foi repovoada predominantemente por células intersticiais com características de fibroblastos, com distribuição de 3,19 + 1,26 cels/µm
2 (Figura 4A).
A coloração de Gomori evidenciou adequada preservação da estrutura extracelular da matriz. As fibras colágenas apresentavam-se bem preservadas, sem evidência de aumento dos espaços interfibrilares (Figura 4B). A coloração de Weigert não demonstrou distorção ou fragmentação das fibras elásticas (Figura 4D).
Próximo à adventícia do conduto observou-se linfócitos com distribuição dispersa 4,40
+ 0,16 cels/µm
2 e monócitos circundando os vasos sanguíneos, na proporção de 7,83
+ 4,69 cels/µm
2.
Na superfície do conduto foram evidenciadas células endoteliais de distribuição focal 6,97
+ 3,96 cels/µm
2, conforme coloração para fator VIII (Figura 4C).
Cúspide
A microscopia ótica demonstrou manutenção da estrutura trilaminar valvar habitual. Foi evidenciado padrão de migração celular da base da cúspide em direção à margem livre. Na cúspide observou-se presença de células intersticiais, predominantemente células mesenquimais, imunomarcadas para Vimentina, com morfologia para fibroblastos e distribuição de 0,91
+ 0,36 cels/µm
2. A população celular na cúspide também foi caracterizada pela presença de células inflamatórias na proporção de macrófagos (CD68): 2,24
+ 1,34 cels/µm
2 e linfócitos (CD3): 1,26
+ 0,27 cels/µm
2.
A base da cúspide apresentava maior quantidade de células intersticiais quando comparada à porção média e distal. Na porção média da cúspide, observou-se predomínio de células inflamatórias, caracterizadas por monócitos e linfócitos.
A porção distal da cúspide era quase acelular e as poucas células encontradas nesta área eram tipicamente células inflamatórias com características para granulócitos, representando uma reação inflamatória inicial não específica.
Espectrometria de absorção atômica
A espectrometria de absorção atômica mostrou alto conteúdo de cálcio no Grupo Crio, quando comparado ao Grupo Desc. A parede arterial dos enxertos criopreservados apresentou um conteúdo médio de cálcio de 1,59
+ 1,02 µg/mg, enquanto que o grupo descelularizado apresentou conteúdo de cálcio de 0,26
+ 0,15µg/mg (P=0,016) (Figura 5). Nas cúspides do Grupo Crio, o conteúdo de cálcio foi de 1,66
+ 0,49 µg/mg, enquanto que, no grupo Desc, foi de 0,49±0,30 µg/mg (P=0,016) (Figura 6).
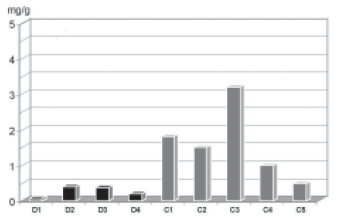
Fig. 5 - Quantificação de cálcio nos condutos dos Heteroenxertos Descelularizados (D) e Homoenxertos Criopreservado (C). Demonstração gráfica do conteúdo de cálcio dos condutos das valvas do Grupo Crio (C) e Grupo Desc (D), P=0,014
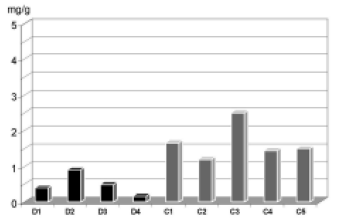
Fig. 6 - Quantificação de cálcio nas cúspides dos Heteroenxertos Descelularizados (D) e Homoenxertos Criopreservados (C). Demonstração gráfica do conteúdo de cálcio nas cúspides das valvas do Grupo Crio (C) e Grupo Desc (D), P=0,016
Não se observou insuficiência pulmonar significativa em nenhum dos grupos analisados. No grupo Desc, a morfologia e a mobilidade das cúspides apresentavam-se inalteradas. Em dois animais do grupo Crio, foi observado pequeno espessamento dos folhetos. Com relação ao diâmetro valvar após 8 meses, foi evidenciado no Grupo Crio um diâmetro médio de 22,5
+ 1,4 mm, enquanto que no Grupo Desc, um diâmetro médio de 27,7
+ 2,1mm (P=0,025). O gradiente transvalvar médio após 8 meses no Grupo Crio e no Grupo Desc foi, respectivamente, 2,24
+ 0,97 e 2,56
+ 0,85 (P>0,05).
DISCUSSÃO
A válvula cardíaca ideal deve ter adequado perfil hemodinâmico, baixa incidência de tromboembolismo e adequada durabilidade. Os homoenxertos apresentam perfil hemodinâmico superior quando comparados aos substitutos valvares convencionais, no entanto, eles ainda apresentam durabilidade limitada, especialmente em pacientes jovens. Além disso, sabe-se que os homoenxertos não apresentam capacidade de crescimento, o que é importante, especialmente na população pediátrica. Apesar dos homoenxertos criopreservados serem estruturas viáveis, eles perdem rapidamente sua celularidade após o implante e não contribuem para a renovação tecidual. De fato, os elementos celulares presentes nos homoenxertos podem ser considerados detrimentais, pois são antigênicos e despertam resposta imune por parte do receptor [9]. O auto-enxerto pulmonar é atualmente o único substituto valvar com capacidade regenerativa e de crescimento, no entanto, a cirurgia de Ross é tecnicamente complexa e realizada em poucos centros capacitados.
Vários grupos descreveram a eficácia da técnica de descelularização com a intenção de diminuir a antigenicidade dos homoenxertos valvares [10]. Além disso, também foi evidenciado que estas matrizes acelulares apresentavam capacidade de serem repovoadas
in vivo por células do receptor após o implante. Apesar de controverso, o uso de heteroenxertos descelularizados é uma técnica bastante promissora devido à pequena disponibilidade de tecidos humanos.
Vários métodos para remover as células dos homoenxertos e heteroenxertos foram propostos, com vários níveis de eficácia no que diz respeito à descelularização e à manutenção da estrutura da matriz. Grauss et al. [7] demonstraram que mudanças na constituição da matriz extracelular após a descelularização química do enxerto poderiam levar a problemas no repovoamento celular por células do hospedeiro, dependendo principalmente do método utilizado para a descelularização. O uso do deoxicolato de sódio foi reportado previamente com sendo um método adequado para a descelularização de valvas porcinas pulmonares e aórticas [11]. No presente estudo, a extração celular com deoxicolato de sódio não resultou em mudanças estruturais significativas na configuração das fibras de colágeno da matriz extracelular, o que é importante para oferecer um adequado ambiente para o processo de remodelamento
in vivoda válvula. Scebacher et al. [12] demonstraram que, além de uma efetiva descelularização do enxerto, a manutenção das propriedades biomecânicas da matriz é de fundamental importância para a durabilidade valvar.
As alterações estruturais que ocorrem nos homoenxertos criopreservados após o implante
in vivo foram amplamente abordadas na literatura. Koolbergen et al. [13] demonstraram que, durante o primeiro ano após o implante, ocorre importante redução na celularidade valvar e que, após um ano, o tecido valvar é quase que acelular. Neste estudo, confirmamos estas observações, no entanto, pudemos evidenciar que o endotélio valvar estava bem preservado na superfície da maioria das valvas criopreservadas. Outros experimentos demonstraram que a capacidade de reendotelização do carneiro é maior que a observada em humanos. Jonas et al. [14] compararam microscopicamente homoenxertos frescos e descelularizados implantados na posição pulmonar de carneiros jovens e encontraram em ambos os grupos a persistência de endotélio revestindo a cúspide valvar.
No presente estudo, também constatamos grande número de linfócitos infiltrando as cúspides e os condutos dos homoenxertos criopreservados quando comparados aos heteroenxertos descelularizados. Neves et al. [15] demonstraram, em um estudo experimental, que o infiltrado linfocitário nos homoenxertos persistiram mais que 2 anos após o implante. Os autores propõem que o infiltrado inflamatório faria parte da reação imunológica causada pelo enxerto, o que levaria ao declínio das células intersticiais e subsequentes alterações histológicas.
Em contraste, no grupo descelularizado, encontramos um processo de repopulação progressiva por células intersticiais mesenquimais, com um padrão de migração celular do conduto em direção à cúspide. A população celular na base da cúspide foi caracterizada como células intersticiais, em maior quantidade em comparação à porção média e distal da cúspide. Em contraste, na porção distal da cúspide foi encontrada uma população maior de células inflamatórias. Este dado sugere que a base do conduto representa uma fase mais antiga do processo de remodelamento celular e indica um padrão de migração celular em direção à margem livre da cúspide. Elkins et al. [16] também descreveram o processo de remodelamento celular em um estudo experimental com valvas porcinas descelularizadas. Sugeriram que a porção média da cúspide e a porção distal representam uma resposta mais recente de remodelamento celular, onde uma população de células inflamatórias mononucleares encontram-se ativada.
Outro importante aspecto é a presença de células endoteliais na superfície dos enxertos descelularizados, dispersas em ilhas, por vezes confluentes. A monocamada de células endoteliais tem a função de preservar os componentes protéicos da matriz subendotelial, além de evitar a proliferação fibrosa na superfície do enxerto. A ausência de uma superfície endotelial antitrombogênica expõe a matriz à corrente sanguínea e aumenta o risco de trombose [17].
Steinhoff et al. [5] sugerem que uma ativa reorganização do tecido em uma matriz bem preservada é um importante pré-requisito para o potencial de crescimento dos enxertos. Nosso estudo demonstrou uma diferença significativa entre os grupos, com relação ao diâmetro dos enxertos pulmonares obtidos por ecocardiografia no oitavo mês após o implante. Uma hipótese possível para explicar esta diferença de diâmetro entre os grupos poderia ser a dilatação da parede do enxerto. Grauss et al. [7] demonstraram perda das glicosaminoglicanos após o processo de descelularização química com Triton X-100, mais precisamente perda do sulfato de condroitina. Este componente é localizado entre as camadas de fibra colágena da matriz e tem a função de diminuir o estresse entre as camadas e evitar a deformação e a dilatação valvar. No presente estudo, não pudemos confirmar a hipótese da dilatação valvar, uma vez que a parede do enxerto não apresentava diminuição de espessura, no momento do explante, quando comparada à valva nativa. Também nos achados ecocardiográficos não se observou insuficiência central do enxerto, o que seria esperado em caso de dilatação valvar.
Em conclusão, os heteroenxertos descelularizados apresentam comportamento biológico diferente quando comparados aos homoenxertos criopreservados, tornaram-se parcialmente repovoados por células endoteliais e intersticiais do hospedeiro e a matiz extracelular manteve-se bem preservada, possibilitando adequado processo de remodelamento celular. Embora os enxertos descelularizados tenham apresentado maior diâmetro quando comparados aos criopreservados, outros estudos incluindo microscopia eletrônica para a avaliação da matriz e uma maior amostragem ainda são necessários para avaliar o possível potencial de crescimento dos enxertos descelularizados.
1. Thomson R, Yacoub M, Ahmed M, Somerville W, Towers M. The use of "fresh" unstented homograft valves for replacement of the aortic valve. J Thorac Cardiovasc Surg. 1980;79(6):896-903. [MedLine]
2. Oei FB, Stegmann AP, van der Ham F, Zondervan PE, Vaessen LM, Baan CC, et al. The presence of immune stimulatory cells in fresh and cryopreserved donor aortic and pulmonary valve allografts. J Heart Valve Dis. 2002;11(3):315-24.
3. Numata S, Fujisato T, Niwaya K, Ishibashi-Ueda H, Nakatani T, Kitamura S. Immunological and histological evalution of decellularized allograft in a pig model: comparison with cryopreservd allograft. J Heart Valve Dis. 2004;13(6):984-90. [MedLine]
4. Leyh RG, Wilhelmi M, Rebe P, Fischer S, Kofidis T, Haverich A, et al. In vivo repopulation of xenogeneic and allogeneic acellular valve matrix conduits in the pulmonary circulation. Ann Thorac Surg. 2003;75(5):1457-63.
5. Steinhoff G, Stock U, Karim N, Mertsching H, Timke A, Meliss RR, et al. Tissue engineering of pulmonary heart valves on allogenic acellular matrix conduits: in vivo restoration of valve tissue. Circulation. 2000;102(19 Suppl 3):III50-5. [MedLine]
6. Bader A, Schilling T, Teebken OE, Brandes G, Herden T, Steinhoff G, et al. Tissue engineering of heart valves: human endothelial cell seeding of detergent acellularized porcine valves. Eur J Cardiothorac Surg. 1998;14(3):279-84. [MedLine]
7. Grauss RW, Hazekamp MG, Oppenhuizen F, van Munsteren CJ, Gittenberger-de Groot AC, DeRuiter MC. Histological evaluation of decellularised porcine aortic valves: matrix changes due to different decellularisation methods. Eur J Cardiothorac Surg. 2005;27(4):566-71. [MedLine]
8. Dohmen PM, da Costa F, Holinski S, Lopes SV, Yoshi S, Reichert LH, et al. Is there a possibility for a glutaraldehyde-free porcine heart valve to grow? Eur Surg Res. 2006;38(1):54-61. [MedLine]
9. Yankah AC, Feller AC, Thiede A, Westphal E, Bernhard A. Identification of surface antigens of endothelial cells of fresh preserved heart allografts: an indication of crossmatching for ABO and HLA antigen? J Thorac Cardiovasc Surg. 1986;34:97-102.
10. Zehr KJ, Yagubyan M, Connolly HM, Nelson SM, Schaff HV. Aortic root replacement with a novel decellularized cryopreserved aortic homograft: postoperative immunoreactivity and early results. J Thorac Cardiovasc Surg. 2005;130(4):1010-5. [MedLine]
11. Dohmen PM, Costa F, Lopes SV, Yoshi S, Souza FP, Vilani R, et al. Results of a decellularized porcine heart valve implanted into the juvenile sheep model. Heart Surg Forum. 2005;8(2):E100-4.
12. Scebacher G, Grasl C, Stoiber M, Rieder E, Kasimir MT, Dunkler D, et al. Biomechanical properties of decellularized porcine pulmonary valve conduits. Artif Organs. 2008;32(1):28-35. [MedLine]
13. Koolbergen DR, Hazekamp MG, de Heer E, Bruggemans EF, Huysmans HA, Dion RA, et al. The pathology of fresh and cryopreserved homograft heart valves: an analysis of forty explanted homograft valves. J Thorac Cardiovasc Surg. 2002;124(4):689-97. [MedLine]
14. Jonas RA, Ziemer G, Britton L, Armiger LC. Cryopreserved and fresh antibiotic-sterilized valved aoritc homograft conduits in a long-term sheep model. J Thorac Cardiovasc Surg. 1988;96(5):746-55. [MedLine]
15. Neves JP, Gulbenkian S, Ramos T, Martins AP, Caldas MC, Mascarenhas R, et al. Mechanisms underlyng degeneration of cryopreserved vascular homografts. J Thorac Cardiovasc Surg. 1997;113(6):1014-21. [MedLine]
16. Elkins RC, Goldstein S, Hewitt CW, Walsh SP, Dawson PE, Ollerenshaw JD, et al. Recellularization of heart valve grafts by a process of adaptive remodeling. Semin Thorac Cardiovasc Surg. 2001;13(4 Suppl 1):87-92. [MedLine]
17. Cebotari S, Mertsching H, Kallenbach K, Kostin S, Repin O, Batrinac A, et al. Construction of autologous human heart valves based on an acellular allograft matrix. Circulation. 2002;106(12 Suppl 1):I63-I68. [MedLine]






 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license