INTRODUÇÃO
A estenose da artéria pulmonar no local de inserção do ducto arterioso, também denominada de coarctação da artéria pulmonar, foi descrita em 1954 por Sondergaard [1]. A estenose na artéria pulmonar justaductal é extremamente comum, podendo acontecer em até 60% dos casos com atresia pulmonar e em até 10% dos pacientes com estenose pulmonar [2-4]. Oliveira et al. [5] descreveram, em nosso meio, em um estudo com avaliação de 766 cateterismos, que existia obstrução pulmonar em 37,7% dos casos com atresia pulmonar, 8,6% nos casos com estenose pulmonar, 17,2% nos casos de tetralogia de Fallot e 28,3% nos casos de dupla via de saída do ventrículo direito com estenose pulmonar. Nos casos de atresia pulmonar com atresia do tronco da artéria pulmonar, os níveis de obstrução podem chegar a 75% [2].
A correção cirúrgica da coarctação da artéria pulmonar deve ser realizada o mais precoce possível, principalmente nos pacientes que têm indicação de correção univentricular [6]. A realização da correção da coarctação da artéria pulmonar permite bom desenvolvimento da árvore pulmonar, favorecendo a vascularização e manutenção de baixa resistência nas artérias pulmonares [7]. Com o retardamento do tratamento cirúrgico, os procedimentos futuros poderão ser mais complexos e com resultado menos favorável devido ao hipodesenvolvimento do pulmão, que recebe menor fluxo sanguíneo [8].
Atualmente, o tratamento da coarctação da artéria pulmonar tem sido realizado ainda no período neonatal e com uso de circulação extracorpórea em vários centros ao redor do mundo [6,7,9]. A utilização de circulação extracorpórea no período neonatal impõe à criança a uma grande estimulação inflamatória e pode dobrar seu volume sanguíneo intravascular [10]. Além disso, pode ser necessária a utilização de hipotermia mais acentuada, com o intuito de diminuir o fluxo arterial, para facilitar a visualização do campo operatório, com a possibilidade de déficit neurológico [11].
Objetivamos, dessa forma, demonstrar a possibilidade e os resultados imediatos da correção cirúrgica da coarctação da artéria pulmonar sem utilização de circulação extracorpórea, como anteriormente relatado por Oliveira et al. [12].
MÉTODOS
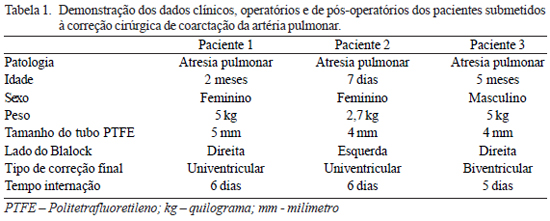
No período entre abril e outubro de 2008, três crianças com coarctação da artéria pulmonar (CoAP) foram operadas no Instituto Nacional de Cardiologia sem utilização de circulação extracorpórea. Duas crianças eram do sexo feminino e uma do sexo masculino. Uma tinha peso de 2,7 kg e as outras duas peso de 5 kg. Uma criança tinha 7 dias de vida e as outras duas 2 e 5 meses (Tabela 1).
Duas crianças apresentavam estenose pulmonar justaductal esquerda e uma justaductal direita com canal arterial nutrindo o ramo direito da artéria pulmonar. Duas apresentavam atresia pulmonar (AP) com comunicação interventricular (CIV), porém com ventrículo direito hipoplásico e, uma, atresia pulmonar com CIV com possibilidade de tratamento biventricular, mas se apresentava em crise cianótica com indicação de confecção de
shunt sistêmico-pulmonar. Todas as crianças tiveram diagnóstico confirmado com angiotomografia com múltiplos detectores previamente à cirurgia e foram submetidas a exame de controle no pós-operatório.
TÉCNICA CIRÚRGICA
O procedimento foi realizado com monitorização da pressão invasiva na artéria radial contralateral à artéria subclávia utilizada para confecção do
shunt sistêmico-pulmonar. Utilizou-se acesso venoso profundo com cateter duplo lúmen e sondagem vesical. O acesso cirúrgico utilizado em todas as crianças foi a esternotomia mediana, com ressecção parcial do tecido do timo.
O saco pericárdico foi incisado em "T" invertido com retirada de um fragmento de pericárdio autólogo, mantido em soro fisiológico, para reconstrução da artéria pulmonar. Realizou-se ampla dissecação dos vasos da base e do canal arterial patente (PCA), expondo claramente a região de coarctação na artéria pulmonar (Figura 1). Todas as crianças tiveram o PCA dissecado cuidadosamente para manter a saturação arterial de oxigênio durante a confecção do
shunt sistêmico-pulmonar na artéria pulmonar contralateral.
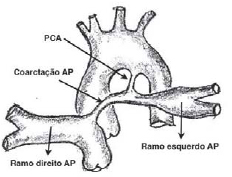
Fig. 1 - Visão anatômica da coarctação da artéria pulmonar e sua relação com o canal arterial patente (PCA). A artéria aorta é vista posteriormente à artéria pulmonar somente para fins de ilustração. Os vasos aórticos e pulmonares são cuidadosamente dissecados, evitando-se a lesão ou espasmo do PCA, que é utilizado para manter a saturação arterial de oxigênio
Utilizou-se infusão de um bolus de 1 mg/kg de heparina, que era repicado se o tempo de coagulação ativada (TCA) estivesse abaixo de 250 segundos. A artéria pulmonar contralateral ao PCA foi amplamente dissecada e reparada por fios. O resquício do tronco da artéria pulmonar foi ligado e seccionado para evitar distorções dos ramos da artéria pulmonar. A artéria subclávia, junto ao tronco braquiocefálico, foi dissecada e reparada por fios, recebendo, então, uma pinça vascular atraumática em posição lateral. Realizou-se uma arteriotomia longitudinal de tamanho ideal para anastomose do tubo de politetrafluoretileno (PTFE), previamente seccionado em bisel. O tubo de PTFE de 4 ou 5 milímetros foi anastomosado, término-lateralmente, na artéria subclávia, com utilização de sutura contínua com fio de polipropileno 7-0 (Figura 1B). A artéria pulmonar recebeu, então, duas pinças vasculares atraumáticas retas em posição transversal, permitindo que não houvesse distorção do PCA. O
shunt sistêmico-pulmonar foi completado com implante término-lateral do tubo de PTFE na artéria pulmonar com sutura contínua com fio de polipropileno 7-0.
Durante todo o procedimento da confecção do
shunt sistêmico-pulmonar, a saturação arterial foi mantida pelo fluxo de sangue pelo PCA na artéria pulmonar contralateral (Figura 1B). As pinças da artéria subclávia e das pulmonares foram retiradas, permitindo fluxo através do
shunt sistêmico-pulmonar, que mantinha a saturação sanguínea de oxigênio durante a reconstrução da artéria pulmonar coarctada.
O PCA foi então amplamente dissecado e ligado duplamente com sutura de polipropileno 6-0. Em seguida, o PCA foi seccionado, permitindo ampla dissecação do restante da artéria pulmonar contralateral ao
shunt sistêmico-pulmonar. Utilizaram-se duas pinças vasculares retas atraumáticas, de modo a deixar uma ampla exposição de artéria pulmonar, que inclui o segmento de estreitamento da coarctação. Nesse período, a saturação sanguínea de oxigênio foi mantida pelo fluxo de sangue pelo
shunt sistêmico-pulmonar confeccionado previamente. Realizou-se uma abertura longitudinal ampla na artéria pulmonar, inclusive no segmento de coarctação. O fragmento de pericárdio autólogo fresco foi utilizado para realizar alargamento da artéria pulmonar com sutura contínua com fio absorvível de polidioxanona (PDS) 7-0 (Figura 3). Após o término da arterioplastia com pericárdio autólogo, as pinças vasculares atraumáticas foram retiradas, restabelecendo o fluxo sanguíneo completo para ambas as artérias pulmonares pelo influxo de sangue pelo
shunt sistêmico-pulmonar. A heparinização foi mantida em bomba de infusão por no mínimo 24 horas, para evitar a formação de trombos nos segmentos manipulados.
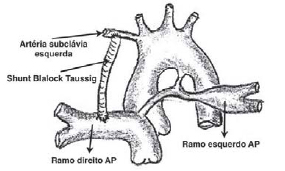
Fig. 2 - Confecção do shunt sistêmico-pulmonar, Blalock Taussig modificado, da artéria subclávia até a artéria pulmonar contralateral ao PCA com tubo de politetrafluoretileno (PTFE) de 4 ou 5 milímetros anastomosado com sutura contínua com fio de polipropileno 7-0
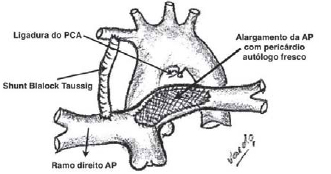
Fig. 3 - Visão do amplo alargamento longitudinal da zona de coarctação da artéria pulmonar com enxerto de pericárdio autólogo fresco com sutura contínua com fio absorvível de polidioxanona (PDS) 7-0. O PCA é ligado e seccionado entre dupla ligadura com fio de polipropileno 6-0, para evitar distorções dos ramos pulmonares
Foram implantados dois tubos de PTFE de 4 mm e um de 5 mm, utilizando a técnica descrita anteriormente. Todas as cirurgias foram realizadas com excelente estabilidade hemodinâmica e sem necessidade de circulação extracorpórea. Todos os pacientes apresentaram boa evolução e alta hospitalar, uma com 5 e duas com 6 dias de pós-operatório (Tabela 1). Todas foram submetidas à avaliação de controle com bom alargamento da região de CoAP avaliada por angiotomografia com múltiplos detectores (Figura 4). As crianças não apresentaram sangramento devido à manutenção da heparinização.
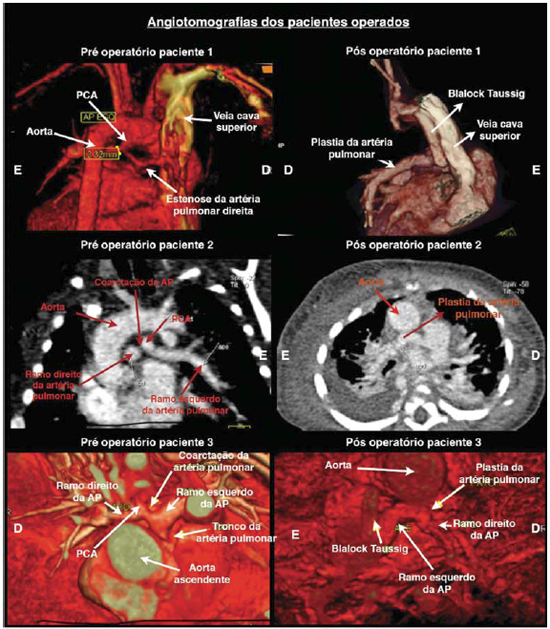
Fig. 4 - Demonstração das angiotomografias de múltiplos detectores dos pacientes submetidos à correção cirúrgica de coarctação da artéria pulmonar
A coarctação da artéria pulmonar é uma afecção descrita há mais de 50 anos e muito comum nos casos que apresentam algum grau de estenose da via de saída do ventrículo direito [1-3]. Luhmer et al. [13] demonstraram que 36%, nove entre 25 neonatos, com cianose devido à obstrução da via de saída do ventrículo direito, apresentavam estenose pulmonar justaductal associada à invasão do tecido ductal na artéria pulmonar. Pelo desconhecimento e/ou pouca investigação das obstruções ao nível das artérias pulmonares, muitas crianças têm sido diagnosticadas apenas tardiamente, piorando o prognóstico, principalmente nos casos com evolução para cirurgia de Fontan.
A necessidade de cirurgia precoce, principalmente nos casos com indicação de correção univentricular, é mandatória e advogada por vários centros ao redor do mundo [6,7,9,14]. O objetivo principal é restabelecer o fluxo adequado para ambas as artérias pulmonares. Desta forma, previne-se a hipoplasia unilateral da árvore arterial pulmonar e, consequentemente, o crescimento de colaterais brônquicas tortuosas [13].
A correção cirúrgica com alargamento da zona de coarctação com uso de pericárdio autólogo é realizada por vários grupos [6,7,9]. A cirurgia é normalmente realizada com circulação extracorpórea, o que ocasiona uma exacerbação da resposta inflamatória com aumento do período de internação e de complicações [10]. O período de internação hospitalar nesse grupo de três pacientes foi de, no máximo, 6 dias (Tabela 1), extremamente curto se comparado com a média de 13,5 ± 12,3 dias, somente de internação em CTI, relatados por outros grupos que realizam o procedimento com circulação extracorpórea [9].
A possibilidade da confecção do
shunt sistêmico-pulmonar utilizando o PCA para manter a saturação arterial de oxigênio é fundamental para a realização do procedimento sem a necessidade de circulação extracorpórea [12]. Para isso, devem-se dissecar as estruturas anatômicas sem que ocorram lesões, espasmo ou distorção do PCA durante o preparo e confecção das anastomoses do
shunt sistêmico-pulmonar (Figura 1C).
CONCLUSÕES
Mesmo em um grupo com pequeno número de pacientes, essa tática parece favorável para o tratamento da coarctação da artéria pulmonar, evitando a utilização de circulação extracorpórea e seus efeitos deletérios. A realização da cirurgia no período neonatal proporciona bom alargamento da estenose da artéria pulmonar com possibilidade de bom desenvolvimento, principalmente no grupo de candidatos a cirurgia de Fontan.
1. Sondergaard T. Coarctation of the pulmonary artery. Dan Med Bull. 1954;1(2):46-8. [MedLine]
2. Elzenga NJ, Gittenberger-de Groot AC. The ductus arteriosus and stenoses of the pulmonary arteries in pulmonary atresia. Int J Cardiol. 1986;11(2):195-208. [MedLine]
3. Elzenga NJ, von Suylen RJ, Frohn-Mulder I, Essed CE, Bos E, Quaegebeur JM. Juxtaductal pulmonary artery coarctation. An underestimated cause of branch pulmonary artery stenosis in patients with pulmonary atresia or stenosis and a ventricular septal defect. J Thorac Cardiovasc Surg. 1990;100(3):416-24. [MedLine]
4. Momma K, Takao A, Ando M, Nakazawa M, Satomi G, Imai Y, et al. Juxtaductal left pulmonary artery obstruction in pulmonary atresia. Br Heart J. 1986;55(1):39-44. [MedLine]
5. Oliveira DM, Monteiro A, Simões LCN, Colafranceschi AS. Fatores anatômicos de risco para o desenvolvimento de obstruções nas artérias pulmonares. Rev SOCERJ. 2009;21(supl A):32.
6. Ishibashi N, Koide M, Uchita S, Seguchi M. When should pulmonary artery angioplasty be performed for Fontan candidates with pulmonary coarctation? Two cases of pulmonary artery angioplasty with the Blalock-Taussig shunt on pump in neonates. Jpn J Thorac Cardiovasc Surg. 2004;52(4):185-8. [MedLine]
7. Shinkawa T, Yamagishi M, Shuntoh K, Miyazaki T, Hisaoka T, Yaku H. Pulmonary arterial reconstruction for pulmonary coarctation in early infancy. Ann Thorac Surg. 2007:83(1):188-92. [MedLine]
8. De Troyer A, Yernault JC, Englert M. Lung hypoplasia in congenital pulmonary valve stenosis. Circulation. 1977;56(4 Pt 1):647-51. [MedLine]
9. Kim HK, Kim WH, Kim SC, Lim C, Lee CH, Kim SJ. Surgical strategy for pulmonary coarctation in the univentricular heart. Eur J Cardiothorac Surg. 2006;29(1):100-4. [MedLine]
10. Karamlou T, Schultz JM, Silliman C, Sandquist C, You J, Shen I, et al. Using a miniaturized circuit and an asanguineous prime to reduce neutrophil-mediated organ dysfunction following infant cardiopulmonary bypass. Ann Thorac Surg. 2005;80(1):6-13. [MedLine]
11. Wernovsky G. Improving neurologic and quality-of-life outcomes in children with congenital heart disease: past, present, and future. J Thorac Cardiovasc Surg. 2008;135(2):240-2.
12. Oliveira DM, Monteiro A, Lino FJS, Binello FCL, Colafranceschi AS. Nova tática cirúrgica para correção da coarctação da artéria pulmonar sem uso de circulação extracorpórea. Rev SOCERJ. 2009;21(supl A):32.
13. Luhmer I, Ziemer G. Coarctation of the pulmonary artery in neonates. Prevalence, diagnosis, and surgical treatment. J Thorac Cardiovasc Surg. 1993;106(5):889-94. [MedLine]
14. Troise DE, Guarnieri GF, Balducci G, Tagliente MR, Arciprete PM, Schinosa LL. Anatomical model at risk of coarctation of the pulmonary artery. Ann Thorac Surg. 2008;85(4):1505. [MedLine]




 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license