RESUMO
OBJETIVO: Avaliar durante o período perioperatório o uso da nifedipina na incidência de lesão renal aguda dos pacientes submetidos à revascularização do miocárdio com circulação extracorpórea. MÉTODOS: Foram estudados, de modo prospectivo e sequencial, 94 pacientes submetidos à revascularização do miocárdio com circulação extracorpórea. As dosagens da creatinina sérica foram realizadas durante pré-operatório e pós-operatório de 24, 48 horas e no 7º dia. Estabeleceu-se como definição para presença de lesão renal a elevação da creatinina sérica 30% em relação ao seu valor basal nas primeiras 24 ou 48 horas de pós-operatório. Os pacientes foram divididos em quatro grupos: G1, que recebeu nifedipina no pré-operatório; G2, que recebeu nifedipina no pós-operatório; G3, que recebeu nifedipina no pré e pós-operatórios e, G4, que não recebeu nifedipina. RESULTADOS: O grupo G4 mostrou maior elevação do percentual de creatinina sérica e maior percentual de pacientes que apresentaram insuficiência renal aguda em relação aos demais grupos no pós-operatório. CONCLUSÃO: Os valores da creatinina sérica e a incidência de lesão renal aguda no pós-operatório sugerem possível efeito nefroprotetor da nifedipina em pacientes submetidos à revascularização do miocárdio com circulação extracorpórea
ABSTRACT
Objective: The objective of this work was to evaluate the influence of the use of nifedipine on the outcome of renal function in patients undergoing myocardial revascularization with extracorporeal circulation. Methods: The casuistics and variables related to extracorporeal circulation were studied. Serum creatinine levels were measured preoperatively, 24, 48 hours and on 7th day postoperatively. Renal failure was defined as an increase in 30% of serum creatinine levels at 24 or 48 hours postoperatively compared to those at baseline. Patients were assigned to four groups: G1 (patients who received nifedipine preoperatively); G2 (patients who received nifedipine postoperatively); G3 (patients who received nifedipine pre and postoperatively) and G4 (patients who did not receive nifedipine). Results: The mean serum creatinine levels postoperatively presented greater rise in G4 (G4>G1=G2=G3), and G4 also presented a higher percentage of patients with acute renal failure (G4>G1 and G4>G3, P<0.05; G1=G3 and G2=G4, P>0.05). Conclusion: The evaluation of serum creatinine values and incidence of acute kidney injury postoperatively suggest a possible nefro-potective effect of nifedipine in patients undergoing myocardial revascularization with extracorporeal circulation.
INTRODUÇÃO
A circulação extracorpórea é identificada pelo organismo como agente agressor, complexo, multifatorial, gerando também resposta multifatorial [1]. As consequências da circulação extracorpórea (CEC) manifestam-se como disfunção transitória de diferentes órgãos, desencadeando uma série de reações e mudanças no equilíbrio fisiológico. Complicações mais graves podem ainda resultar em falência de múltiplos órgãos (SIRS) e morte [2]. Entre estas, uma das principais é a lesão renal aguda (LRA), que se caracteriza pelo declínio abrupto da função renal, resultando em retenção sérica de produtos nitrogenados [3]. Sua incidência em cirurgia cardiovascular é variável (5% a 39%), dependendo do grau de perda da função, considerado como critério diagnóstico de insuficiência renal aguda [4].
Doenças associadas, idade avançada, função renal comprometida, cirurgia de emergência e obesidade são reconhecidos como fatores de predisposição para ocorrência de insuficiência renal aguda (IRA) [4]. O fluxo não-pulsátil durante a CEC é um importante fator que resulta em vasoconstrição renal e lesão por isquemia [3].
Ao lado de aspectos clássicos do mecanismo da IRA, mecanismos moleculares e celulares, especificamente o cálcio e outras moléculas, estão envolvidos com o fenômeno isquêmico [5].
Os inibidores dos canais de cálcio contribuem no tratamento da hipertensão, insuficiência coronariana e de alterações no ritmo cardíaco. Foram utilizados previamente e após insulto renal no tratamento de doença arterial coronariana [6]. Sua atuação interrompe a progressão da isquemia para morte celular, reduzindo o transporte do íon cálcio e sua utilização pelas mitocôndrias. Mesmo não sendo medida terapêutica de rotina, seu benefício foi observado em transplantes renais, na nefrotoxicidade por ciclosporina e em procedimentos com contrastes iodados [7-9].
Frente a referências da literatura destacando o papel do íon cálcio na lesão celular da LRA e relatos sobre a provável proteção dos inibidores dos canais de cálcio, atenuando a agressão renal, julgamos oportuno investigar o possível papel protetor da nifedipina sobre a agressão renal no período perioperatório de cirurgia de revascularização do miocárdio com CEC.
MÉTODOS
Foram estudados sequencialmente, de forma prospectiva, 94 pacientes internados na enfermaria de cirurgia cardiovascular do Hospital das Clínicas da Faculdade de Medicina de Botucatu, UNESP - Universidade Estadual Paulista, no período de novembro de 2003 a dezembro de 2004. Os pacientes foram divididos em quatro grupos em função da decisão quanto ao uso e à forma de administração da nifedipina pela equipe médica que assistiu aos pacientes:
G1, composto por 16 pacientes que receberam nifedipina no período pré-operatório; G2, composto por 29 pacientes que receberam nifedipina no período pós-operatório; G3, composto por 34 pacientes que receberam nifedipina nos períodos pré e pós-operatórios e G4, composto por 15 pacientes que não receberam nifedipina.
Para os critérios de exclusão foram estabelecidos: duração da CEC superior a 2 horas e 30 minutos; pressão arterial média inferior a 50 mmHg por mais de 10 minutos durante a CEC, idade superior a 70 anos; reoperação; outra cirurgia associada; cirurgia de emergência; utilização do dispositivo de contrapulsação; lesão renal crônica.
O protocolo do estudo constou de: inclusão do paciente após seu consentimento, identificação de co-morbidades pré-operatórias; observação da prescrição médica; avaliação laboratorial de rotina e dosagem da creatinina sérica 24 horas antes da cirurgia. No procedimento cirúrgico houve identificação de fatores de risco intra-operatório (CEC) e avaliação laboratorial para manejo da CEC. No pós-operatório imediato (24 e 48 horas) e no pós-operatório tardio (7º dia), houve avaliação laboratorial com dosagem de creatinina sérica e observação da prescrição médica; no 7º dia houve encerramento do protocolo.
O protocolo de perfusão utilizado pelo nosso Serviço constou de: perfusato composto de solução de cloreto de sódio a 0,9% e manitol a 20%. Após heparinização sódica na dose de 4 mg/kg e tempo de coagulação ativada (TCA) acima de 480 segundos, houve instalação das cânulas e início da CEC com fluxo arterial em torno de 60ml/kg/min, mantendo pressão arterial média (PAM) de 60 mmHg e temperatura corporal entre 28ºC a 30ºC. Após o pinçamento da aorta, foi realizada proteção miocárdica anterógrada, hipotérmica e intermitente com doses de indução e manutenção. Finalizada a CEC e removidas as cânulas, foi administrado cloridrato de protamina, na dose 1:1, de forma a atingir TCA igual ou inferior a 120 segundos.
Estabeleceu-se como critério de IRA a elevação da creatinina sérica de 30% em relação ao seu valor basal nas primeiras 24 ou 48 horas do procedimento cirúrgico, excluídas de causas pré-renais. Esse critério é utilizado em nosso Serviço, pois eleva a sensibilidade de diagnóstico, contribuindo para a atuação precoce do nefrologista [3,10,11]. Para a determinação da creatinina sérica, foram coletadas amostras de sangue em 4 momentos: M1, pré-operatório; M2, 24 horas no pós-operatório; M3, 48 horas no pós-operatório e M4, 7°dia de pós-operatório.
O inibidor do canal de cálcio utilizado foi Nifedipina (Adalat Retard®, Bayer), na dose de 10 a 20 mg, a cada 8 horas. A retirada da medicação do período pré-operatório foi feita na véspera da cirurgia e sua reintrodução ocorreu no pós-operatório imediato.
Este trabalho foi submetido à avaliação do Comitê de Ética e Pesquisa do Hospital das Clínicas da Faculdade de Medicina de Botucatu - UNESP, e aprovado em 3/11/2003.
Na análise estatística, foi utilizado modelo de regressão para medidas repetidas (proc mixed do programa SAS), no qual foram calculados valores da creatinina sérica, sendo esta a única variável com distribuição normal (calculada a média). Feito ajuste de distribuição gama (modelo linear generalizado com erro assumindo distribuição gama) para variáveis que não tiveram distribuição normal. Para variáveis da CEC foi utilizado modelo linear generalizado (proc genmod do programa SAS) com erro distribuição gama e função de ligação log. O teste exato de Fisher foi utilizado para calcular o percentual dos pacientes que tiveram elevação da creatinina sérica superiores a 30% (Δ30%). Com nível de significância de 5% (valor de P<0,05).
RESULTADOS
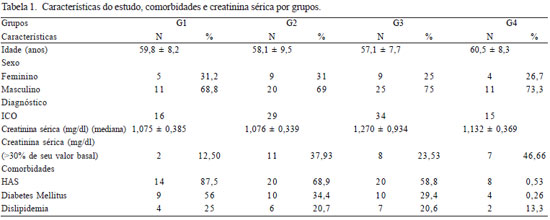
Foram acompanhados 94 pacientes descritos na Tabela 1, com médias de idades entre 57 e 60 anos nos grupos, sendo 67 (73,3%) pacientes do sexo masculino. Para cada grupo estudado, observamos a presença de co-morbidades [hipertensão arterial sistêmica (HAS), diabetes mellitus, dislipidemia], cálculo de mediana para creatinina séricas e cálculo para o aumento de 30% do valor basal da creatinina sérica caracterizando a LRA.
Não houve diferença estatística entre os grupos estudados em relação aos parâmetros da CEC (Tabela 2).
Na Tabela 3, observamos que não houve associação entre as variáveis: gênero e grupos com a presença ou ausência das comorbidades (HAS, diabetes mellitus, dislipidemia) e a análise estatística demonstrou não haver diferença significativa entre os dados obtidos.
A LRA foi diagnosticada em 28 (29,7%) pacientes, ou seja, com creatinina sérica superior a 30% de seu valor basal no 1º e 2º pós-operatório, onde G4>G1 para valor de P=0,05 e G4>G3 para valor de P =0,001, observados na Figura 1.

Fig. 1 - Percentual dos pacientes com creatinina sérica superior a 30% de seu valor basal segundo grupos, onde G4>G1 para P=0,05; G4>G3 P=0,001 e G1=G3 e G2=G4 P>0,05
Na Figura 2, a média da creatinina sérica não apresentou diferença estatística entre os grupos estudados (G1, G2, G3, G4), porém entre os grupos e momentos (M1, M2, M3, M4) observamos aumento da creatinina sérica especificamente no grupo G2 (medicação pós-operatório) no momento M1 (pré-operatório) para M2 (pós-operatório de 24 horas). Em relação aos demais grupos (G1, G3, G4), não houve diferença estatística em relação aos momentos (M1, M2, M3, M4).
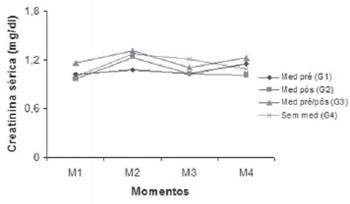
Fig. 2 - Médias dos valores da creatinina sérica segundo momentos e grupos, onde M1 para M2 com P<0,05
Calculadas as médias dos percentuais dos deltas (%") de creatinina sérica, onde verificamos aumento da creatinina sérica no G4 nos momentos de 24 horas (58%) e 48 horas (50%) no pós-operatório, valor este que decresce no 7º dia (30%), sendo significativo (P<0,05) em relação aos demais grupos estudados, e G1=G2=G3 (P >0,05). Observamos maior comprometimento renal no G4 (Figura 3).
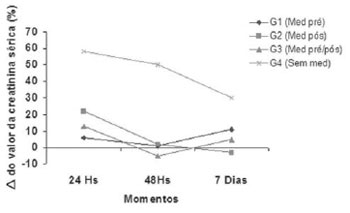
Fig. 3 - Médias dos valores dos percentuais dos deltas (D %) de creatinina sérica entre os momentos nos grupos, onde G4 <0,05
A LRA pode ocorrer no período pós-operatório de qualquer cirurgia e é referida como a redução aguda da função renal em horas ou dias. Apesar dos avanços tecnológicos na monitorização e cuidados dos pacientes, seu prognóstico continua grave, podendo levar à morte.
O diagnóstico de LRA no presente estudo baseou-se no aumento da creatinina sérica, definida como igual ou maior a 30% de seu valor basal nas primeiras 24 e 48 horas do pós-operatório. Este critério foi descrito por Barretti & Soares [10] e Balbi et al. [11] em trabalhos realizados em nossa Instituição, nos quais identificaram como a principal causa de LRA intrínseca a isquemia, sendo responsável por aproximadamente 50% dos casos.
Em cirurgia cardiovascular, vários estudos ao longo do tempo vêm referindo que a LRA é uma complicação frequente, estando associada a altas taxas de mortalidade e permanência prolongada na UTI [12-14]. Machado et al. [12] referem mortalidades em 30 dias de pacientes com e sem lesão renal aguda de 12,6% e 1,4%, respectivamente. Thakar et al. [15] conferem à LRA alto risco independente para mortalidade em relação a outras complicações no pós-operatório e desenvolveram um "escore" de predição de LRA no pós-operatório de cirurgia cardíaca, incorporando todos os maiores fatores de risco [16]. Para Kochi et al. [3], a identificação de fatores contributivos para o desenvolvimento da LRA pós-cirurgia cardíaca possibilita a adoção precoce de condutas para evitar disfunção renal e diminuir a mortalidade.
Há numerosas evidências de que os efeitos deletérios da CEC sobre os rins estão relacionados à duração da perfusão e demais condições da CEC [1,3,17-20]. Stallwood et al. [20] relataram que a CEC isoladamente está associada ao aumento significativo do risco IRA nos pacientes coronariopatas. O fluxo sanguíneo renal e o ritmo de filtração glomerular durante a CEC são reduzidos em até 75% com parcial, mas não completo, restabelecimento após o primeiro pós-operatório.
A análise das condições da CEC em nosso estudo demonstrou que não houve diferença estatística entre os grupos em relação aos parâmetros peri-operatórios da CEC.
Epstein [8] demonstrou que os inibidores dos canais de cálcio exercem efeitos benéficos sobre função renal. Em estudos experimentais em rim de ratos, utilizando técnicas videoscópicas que permitiram direta visualização das arteríolas eferentes, verificou-se que os inibidores dos canais de cálcio antagonizam a vasoconstrição glomerular [9]. Isto somado ao seu efeito natriurético sugere que seu uso possa prevenir ou reduzir a ocorrência LRA.
Bertolissi et al. [21] avaliaram os efeitos sobre função renal da administração contínua de nifedipina durante a CEC. Observaram que a infusão contínua de nifedipina durante a CEC reduziu a ocorrência de LRA e destacam que isto pode constituir em ferramenta adicional para proteção da função renal em pacientes submetidos à cirurgia cardíaca com CEC, diminuindo o influxo de cálcio nos canais lentos e produzindo vasodilatação das artérias.
Stafoord-Smith [22] referem que mesmo não sendo medida terapêutica de rotina, o benefício os inibidores dos canais de cálcio pode ser utilizado para o tratamento dos pacientes que apresentam elevações da creatinina sérica, em média, 48 horas após a cirurgia cardíaca com CEC, sem a necessidade de diálise.
Os nossos resultados mostraram no grupo G4 (sem nifedipina) aumento do valor basal da creatinina sérica de, respectivamente, 58% e 50% nos momentos 24 horas (M2) e 48 horas (M3) no pós-operatório, valor que decresce para 30% no 7º dia de pós-operatório tardio (M4), valores elevados em relação aos demais grupos (G1, G2, G3), demonstrando maior comprometimento deste grupo.
Os pacientes que desenvolveram LRA no grupo G4 foi de 46,66%, em relação ao G1 de 12,5%, no G2 de 37,93% e no G3 de 23,53%, reforçando a hipótese que a nifedipina possa reduzir a ocorrência de LRA no pós-operatório de pacientes submetidos à cirurgia cardíaca com CEC quando comparado ao trabalho realizado por Bertolissi et al. [21].
A maior incidência de LRA no grupo G4 (sem nifedipina) do que nos grupos G1 (nifedipina pré-operatório) e G3 (nifedipina pré e pós-operatório) pode estar relacionada a efeito protetor da nifedipina administrada no período pré-operatório, seguindo o protocolo de nosso estudo.
O grupo G2 (nifedipina pós-operatório) apresentou aumento da média dos valores creatinina sérica do momento M1 (pré-operatório) para o momento M2 (24 horas pós-operatório), mas não demonstrou diferença nas médias de creatinina em relação aos grupos G1 (pré-operatório) e G3 (pré e pós-operatório). Talvez este comportamento se deva ao fato dos pacientes deste grupo (G2) terem recebido nifedipina apenas no período pós-operatório e da administração da droga ter iniciado muito próximo à coleta de sangue para a dosagem da creatinina de 24 horas, quando seu efeito ainda era pequeno ou mesmo inexistente.
Assim, acreditamos que as referências sobre possível efeito nefroprotetor da nifedipina, a sua frequente utilização por pacientes portadores de insuficiência coronária, como descrevem Lopes et al. [6], e a importância de ferramentas para prevenção de lesão renal em pacientes submetidos à revascularização do miocárdio com CEC, justificam a realização de novos estudos nessa linha.
CONCLUSÃO
No período pós-operatório, a média do percentual das médias dos deltas de creatinina sérica foram maiores no grupo G4 (sem nifedipina) em relação aos demais grupos. O percentual de pacientes com valores de creatinina sérica superior a 30% de seu valor basal nas 48 horas de pós-operatório também foi maior no grupo G4 (sem nifedipina) em relação aos pacientes dos grupos G1 (nifedipina pré-operatório) e G3 (nifedipina pré e pós-operatório). O comportamento da creatinina sérica e a incidência LRA no período pós-operatório nos diferentes grupos reforçam a hipótese de efeito nefroprotetor da nifedipina nos pacientes submetidos à revascularização do miocárdio com CEC.
REFERÊNCIAS
1. Souza MAL, Elias DO. Fundamentos da circulação extracorpórea. Rio de Janeiro:Centro Editorial Alfa Rio;1995. v.1. p.441.
2. Moura HV, Pomerantzeff PMA, Gomes WJ. Síndrome da resposta inflamatória na circulação extracorpórea: papel das interleucinas. Rev Bras Cir Cardiovasc. 2001;16(4):376-87.
3. Kochi AC, Martins AS, Balbi AL, Moraes e Silva MA, Lima MCP, Martins LC, et al. Fatores de risco pré-operatórios para o desenvolvimento de insuficiência renal aguda em cirurgia cardíaca. Rev Bras Cir Cardiovasc. 2007;22(1):33-40. [MedLine] Visualizar artigo
4. Chertow GM, Levy EM, Hammermeister KE, Grover F, Daley J. Independent association between acute renal failure and mortality following cardiac surgery. Am J Med. 1998;104(4):343-8. [MedLine]
5. Carvalho da Costa M, Burdmann EA, Yu L. Insuficiência renal aguda isquêmica. In: Homsi E, editor. Insuficiência renal aguda em UTI. São Paulo:Atheneu;1998. p.69-82.
6. Lopes NH, da Silva Paulitsch F, Pereira A, Garzillo CL, Ferreira JF, Stolf N, et al. Mild chronic kidney dysfunction and treatment strategies for stable coronary artery disease. J Thorac Cardiovasc Surg. 2008;137(6):1443-9.
7. Santos BFC, Anção MS, Korn D, Santos OFP. Insuficiência renal aguda. In: Knobel E, editor. Condutas no paciente grave. São Paulo:Atheneu;1997. p.386-98.
8. Epstein M. Calcium antagonists and renal protection. Current status and future perspectives. Arch Intern Med. 1992;152(8):1573-84. [MedLine]
9. Epstein M. Calcium antagonists and the kidney: future therapeutic perspectives. Am J Kidney Dis. 1993;21(6 Suppl 3):16-25. [MedLine]
10. Barretti P, Soares VA. Insuficiência renal aguda. J Bras Nefrol. 1997;173(4):101-6.
11. Balbi AL, Barsnate RC, Silva VS, Martin LC, Camaroni JT. Insuficiência aguda em um hospital universitário: o que mudou em 10 anos? J Bras Nefrol. 2002;24(suppl 2):159.
12. Machado MN, Miranda RC, Takakura IT, Palmegiani E, Santos CA, Oliveira MA, et al. Lesão renal aguda após revascularização do miocárdio. Arq Bras Cardiol. 2009,93(3):247-52. [MedLine]
13. Santos FO, Silveira MA, Maia RB, Monteiro MDC, Martinelli R. Insuficiência renal aguda após cirurgia de revascularização do miocárdio com circulação extracorpórea: incidência, fatores de risco e mortalidade. Arq Bras Cardiol. 2004;83:145-8.
14. Novis BK, Roizen MF, Aronson S, Thisted RA. Association of preoperative risk factors with postoperative acute renal failure. Anesth Analg. 1994;78(1):143-9. [MedLine]
15. Thakar CV, Liangos O, Yared JP, Nelson D, Piedmonte MR, Hariachar S, et al. ARF after open-heart surgery: influence of gender and race. Am J Kidney Dis. 2003;41(4):742-51. [MedLine]
16. Thakar CV, Arrigain S, Worley S, Yared JP, Paganini EP. A clinical score to predict acute renal failure after cardiac surgery. J Am Soc Nephrol. 2005;16(1):162-8. [MedLine]
17. Teixeira Filho GF. Temas atuais de circulação extracorpórea. Porto Alegre:SBCEC;1997. p.301.
18. Abu-Omar Y, Ratnatunga C. Cardiopulmonary bypass and renal injury. Perfusion. 2006;21(4):209-13. [MedLine]
19. Raja SG, Dreyfus GD. Impact of off-pump coronary artery bypass surgery on postoperative renal dysfunction: current best available evidence. Nephrology (Carlton). 2006;11(4):269-73.
20. Stallwood MI, Grayson AD, Mills K, Scawn ND. Acute renal failure in coronary artery bypass surgery: independent effect of cardiopulmorary bypass. Ann Thorac Surg. 2004;77(3):968-72. [MedLine]
21. Bertolissi M, Antonucci F, De Monte A, Padovani R, Giordano F. Effects on renal function of a continuous infusion of nifedipine during cardiopulmonary bypass. J Cardiothorac Vasc Anesth. 1996;10(2):238-42. [MedLine]
22. Stafoord-Smith M. Perioperative renal dysfunction: Implications and stratigies for protection. In: Newman MF, editor. Perioperative organ protection. Baltimore:Society of Cardiovascular Anesthesiologists;2003. p.89-124.
Article receive on sábado, 25 de julho de 2009





 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license