INTRODUÇÃO
Muitos pacientes portadores de graus avançados de insuficiência cardíaca (IC) apresentam elevações da pressão da artéria pulmonar e a hipertensão pulmonar (HP) grave é considerada contra-indicação ao transplante ortotópico, devido ao risco de falência aguda ou crônica do ventrículo direito pela inabilidade de adaptação a pressões altas no território pulmonar após seu implante no receptor[1,2].
Entretanto, alguns pacientes com moderada para grave HP são transplantados com sucesso, nos quais são feitas avaliações hemodinâmicas na seleção pré-operatória demonstrando decréscimo progressivo de pressão da artéria pulmonar, ilustrando a reversibilidade da HP[3-5]. Testes hemodinâmicos da reversibilidade potencial da HP pela administração de FIO2 100%, nitroglicerina ou nitroprussiato de sódio são frequentemente empregados na avaliação dos candidatos ao transplante cardíaco (TxC)[6,7].
Inquestionavelmente, o TxC é o tratamento da escolha para pacientes nos estágios finais da IC e o aumento da resistência vascular pulmonar (RVP) pode determinar riscos elevados a curto e a longo prazos, constituindo-se em dificuldade na seleção dos candidatos[8], de maneira que portadores de RVP alta, fixa e irresponsiva à terapêutica vasodilatadora são frequentemente contra-indicados ao TxC[9,10].
O grau da HP e sua reversibilidade diante da vasodilatação pulmonar tem importante impacto na evolução pós-transplante. Os níveis de HP acima dos quais a mortalidade aumenta são variados na literatura[11,12], e muitas técnicas tem sido descritas para reduzi-la antes e após a cirurgia[13,14] e, desde os trabalhos iniciais relatando a relação entre RVP elevada e aumento de mortalidade após TxC ortotópico, tem sido observadas diferentes conclusões[15].
O emprego da técnica ortotópica é indicado nos portadores de RVP inferior a 5w, e os com RVP entre 5 e 8w seriam candidatos ao transplante heterotópico[16], cujas vantagens se referem a[17]:
1. O coração do receptor atua como dispositivo de circulação assistida e pode manter a circulação:
1. após perda reversível ou irreversível da função do coração por rejeição aguda ou crônica;
2. durante o período de adaptação, no caso de coração pequeno para o tamanho do receptor;
2. Possibilita a recuperação do coração nativo nas disfunções agudas;
3. Pode ser realizado mesmo na presença de elevada RVP.
Suas desvantagens se referem a:
1. Risco de embolia sistêmica devido ao coração do receptor;
2. Necessidade de anticoagulação permanente;
3. Persistência da angina nos portadores de cardiomiopatia isquêmica;
4. Risco de infecção ou trombos nos pacientes com próteses valvares;
5. Arritmias que necessitam tratamento com drogas que possam comprometer a função do enxerto.
A diretriz sobre Transplante Cardíaco da Sociedade Brasileira de Cardiologia[18] recomenda a realização de estudo hemodinâmico com ou sem vasodilatadores (nitroprussionato de sódio, óxido nítrico, prostaglandina) e considera os achados de RVP < 4w como bom prognóstico; RVP > 4w e Gradiente Transpulmonar (GTP) > 15mmHg como risco maior; e RVP
> 6w (não ou pouco responsivo a vasodilatadores) como contra-indicação à técnica ortotópica, sendo indicada a heterotópica.
Costard-Jackle et al.[19] entendem que RVP > 2,5w sem teste com hipotensor, e
< 2,5w após ou sem redução £ da pressão arterial sistólica sistêmica (PASS), a mortalidade no 3º mês de pós-operatório é elevada e Mehra et al. (
International Society for Heart and Lung Transplant Guidelines) chamam a atenção para Pressão da Artéria Pulmonar (PAP)
> 50 mmHg ou GTP
> 15 mmHg ou RVP > 3w com PASS > 85mmHg, havendo indicação para teste de responsividade com vasodilatador (classe I nível evidência C). Não ocorrendo resposta do vasodilatador, a indicação é para assistência mecânica circulatória por HP irreversível (classe II b, nível evidência C), estando contra-indicado o TxC ortotópico[20].
MÉTODOS
No período que compreende 1992 a 2007, foram realizados na Seção Médica de Transplante do Instituto Dante Pazzanese de Cardiologia/São Paulo, 228 TxC em 228 pacientes pelas técnicas clássica (21-9,2%), bicaval unipulmonar (oito-3,5%), bicaval bipulmonar (197-86,4%) e heterotópico (dois-0,8%). Desta série foram selecionados sete pacientes portadores de níveis elevados de RVP e GTP e pouco ou nada responsivos à terapêutica vasodilatadora com nitroprussiato de sódio endovenoso (NS) aplicado por ocasião do estudo hemodinâmico realizado na fase de avaliação e seleção dos receptores.
A maioria (seis) dos pacientes era do sexo masculino, com idade variando entre 29 a 64 anos (46,2±12,7 anos), portadores de miocardiopatia dilatada (quatro), chagásica (dois) e isquêmica (um).
Diante destes dados, estes pacientes foram aceitos como candidatos a TxC heterotópico e foram inscritos na Lista Única da Central de Notificação e Captação de Distribuição de Órgãos (CNCDO) da Secretaria de Saúde do Estado de São Paulo, ocasião na qual foi adotada a estratégia de solicitar equivalência de peso e superfície corporal doador/receptor à semelhança dos candidatos ao TxC ortotópico.
Com o receptor na sala de operações, com controle contínuo de PAM, ECG, PVC, temperatura e diurese, em anestesia geral com ventilação mecânica e o coração exposto por toracotomia mediana, nos momentos que antecediam o início do implante do órgão doador, a artéria pulmonar era cateterizada com jelco[14] e avaliada contínua e simultaneamente a PSAP (mmHg) com a PSAS (mmHg), inicialmente com FIO2 variáveis até concentrações de 100% e após a infusão de NS.
Os doadores tinham idade entre 18 e 49 anos (30,3±11,3) e as causas do coma encefálico foram traumatismo cranioencefálico (três), acidente vascular cerebral hemorrágico (dois), anoxia cerebral (um) e tumor cerebral (um). A origem destes doadores foi OPO HC/SP 3, OPO IDPC/SP 3, OPO EPM/SP 1.
Com a chegada do enxerto à sala de operações, o receptor era colocado em circulação extracorpórea (CEC) pela canulação da aorta ascendente e seletiva de ambas as veias cavas e, após seu início, a temperatura era rebaixada ao redor de 25ºC. O órgão nativo era removido integralmente, permanecendo apenas cotos das veias pulmonares direita, esquerda, veias cavas inferior e superior, artéria pulmonar e aorta.
A proteção miocárdica do enxerto era feita por meio da infusão de 1000ml de solução cristalóide de cardioplegia a 4ºC (KCl 19,1% 6ml, NaHCO2 2ml) na raiz da aorta. no momento da retirada do órgão no doador, o qual a seguir era acondicionado em recipiente estéril contendo soro fisiológico a 4ºC e em sacos plásticos estéreis, sendo o conjunto colocado em caixa isotérmica com gelo para transplante. Antes do início do implante, já na sala de operações do receptor, este recebia outra infusão (500ml) de solução cristalóide de cardioplegia a 4ºC na raiz da aorta, repetida ao redor de cada 40 minutos durante o implante.
As anastomoses eram iniciadas pelas veias pulmonares esquerda, direita, veia cava inferior, superior, artéria pulmonar e aorta, pela técnica de TxC ortotópico bicaval bipulmonar[21].
Concluídas as anastomoses e após a normalização da temperatura, os batimentos eram recuperados, interrompendo-se a CEC. Após neutralizada a heparinemia com sulfato de protamina, a hemostasia era revisada e feita a síntese do tórax por planos.
RESULTADOS
Os achados pressóricos encontrados por ocasião do estudo hemodinâmico na avaliação pré-operatória dos candidatos a transplante pulmonar são apresentados na Tabela 1.
Os achados pressóricos encontrados nos momentos que antecederam ao implante do órgão doado, sem e com uso de NS, permitem verificar o impacto do vasodilatador sobre as circulações sistêmicas e pulmonares (Tabela 2, Figuras 1 e 2).

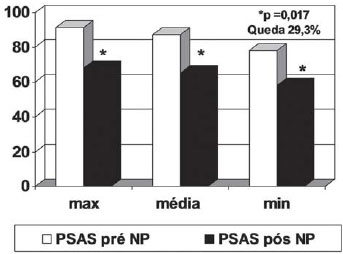
Fig.1 - Pressões arteriais sistêmicas no intra-operatório pré e pós uso de nitroprussiato de sódio
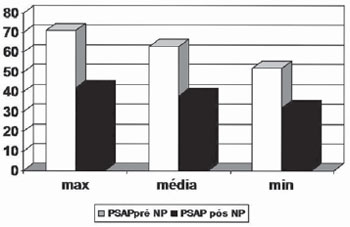
Fig. 2 - Pressões arteriais pulmonares no intra-operatório pré e pós uso de nitroprussiato de sódio
Diante destes resultados, todos os pacientes foram considerados a receber o implante de maneira ortotópica, tendo em vista os órgãos alocados serem adequados na relação peso/superfície corporal receptor/doador.
O tempo de isquemia variou entre 110 a 182 minutos (139,2±25,6 min) e o tempo de implante entre 72 a 118 minutos (95±14,3 min).
A evolução na fase hospitalar foi dentro da rotina, todos recebendo alta hospitalar entre o 10º e o 21º dia de pós-operatório. A sobrevida destes pacientes é de 3 meses a 6 anos, todos evoluindo estáveis dentro do previsto.
DISCUSSÃO
A ocorrência de HP elevada é considerada fator de risco de mortalidade a curto e a longo prazos após o TxC, tendo sido demonstrada correlação da RVP com mortalidade de modo linear, e a importância da terapia vasodilatadora na avaliação pré-transplante tem sido relatada nos portadores da HP elevada, observando-se conflitos de opiniões quanto ao grau da HP associado a prognóstico desfavorável[8,19].
Entretanto, tem sido descrito queda de RVP imediatamente e em prazos maiores após o transplante em pacientes com índices elevados de HP. A despeito de dados convincentes de que a HP é fator de risco independente de óbito, estudos multicêntricos carecem de identificar os níveis específicos de RVP e GTP acima do qual o risco de óbito é considerável. A definição consistente para RVP, os diversos métodos de teste de reversibilidade, não padronização nos períodos analisados pós TxC tem variado nas publicações, não se estabelecendo por isso consenso[22,23].
Assim, Chen et al.[8] descreveram baixa mortalidade nos primeiros 30 dias pós TxC em pacientes com RVP > 3w. Delgado et al., numa série de pacientes com GTP > 12mmHg e RVP > 2,5w, com ou sem resposta ao vasodilatador, encontraram significativa mortalidade naqueles com HP e RVP baixas. Outros autores[23] não localizaram diferenças na mortalidade precoce e tardias em casos com RVP > 3w e GTP > 12mmHg e, por sua vez, Klotz et al.[11] não mostraram diferenças na sobrevida pós TxC nos portadores de HP alta e baixa.
Em trabalho recente, Chang et al.[15] descreveram correlação significativa entre RVP cm HP leve a moderada pré TxC, nos primeiros 6 meses de evolução de pós-operatório, o mesmo não acontecendo em evoluções maiores e, nos casos de HP elevadas, a mortalidade imediata foi maior, sem impacto a longo prazo.
Por outro lado, é importante o conhecimento que, em muitos programas de TxC, pacientes com estas características sejam encaminhados à técnica heterotópica ou mesmo de coração/pulmão, utilizando-se a estratégia de aceitar doadores com maior peso e superfície corporal para os portadores de HP elevada reversível ou parcialmente reversível pela técnica ortotópica[24].
A redução da RVP geralmente ocorre imediatamente após o transplante e é devida a seu componente reversível[22], contudo, há relatos da sua irreversibilidade em evolução até 5 anos nos portadores de HP elevada, assim como nos casos de RVP elevada, porém reversível, ocorre redução contínua tempo-dependente[23]. As taxas de complicações e mortalidade são independentes de RVP pré TxC e o aumento do débito cardíaco e a queda do GTP não são os únicos fatores que determinam a queda da RVP. Chang et al.[15] concluíram que a queda da RVP estava relacionada ao aumento do débito cardíaco sem mudanças no GTP, assim como foi encontrada redução da RVP (<3w) em 83% dos casos com HP leve a moderada e em 80% naqueles com a forma grave[24]. Estes pacientes apresentavam sobrevida melhor e maior quando comparados àqueles com HP
> 3w no primeiro ano por TxC; e a RVP nos primeiros 30 dias foi semelhante à encontrada após decorridos os primeiros 12 meses, geralmente em valores normais ou próximos à normalidade, fazendo pressupor que a grande maioria dos portadores da HP elevada tem componentes da reversibilidade.
A queda de RVP e GTP, diante do aumento do débito cardíaco gerado pelo órgão transplantado, suporta teoria de componentes de reação lenta da RVP tempo-dependente pós TxC, sendo possível se concluir que RVP leve, moderada ou grave reversível não tem influência negativa a curto e a longo prazos pós-transplante quando são utilizados ortotopicamente corações de doadores maiores, e a HP residual se associa à redução de sobrevida a longo prazo[25].
A avaliação da reversibilidade da HP nos momentos que antecedem ao implante do coração doado tem características peculiares, que não ocorrem nos testes pressóricos na fase de seleção dos candidatos, onde estes procedimentos são realizados no laboratório de hemodinâmica com o paciente consciente, respirando espontaneamente com FIO2 mais baixos. Na sala de operações, os pacientes estão em plano cirúrgico de anestesia, com ventilação mecânica e FIO2 mais altas e estas diferenças podem ser as responsáveis pelos achados obtidos neste trabalho, absolutamente diferentes daqueles da fase pré-operatória.
A HP gerada pelo excesso de fluxo sanguíneo nas cardiopatias congênitas que culminaram com níveis pressóricos elevados e fixos (síndrome de Eisenmenger) é bem conhecida e estratificada. O mesmo não acontece com HP originária de graus aprofundados da IC, cujo espectro é muito variado e de fisiopatologia pouco conhecida.
Por outro lado, a técnica ortotópica para o TxC é adequada, porque o órgão doado substitui o nativo e resgata integralmente o organismo debilitado e depauperado, restituindo expectativa e qualidade de vida. A aplicabilidade da técnica heterotópica com seus inúmeros inconvenientes é excepcional e se restringe aos portadores da HP irresponsiva apenas.
Diante das evidências da literatura e as obtidas neste trabalho, surgem dúvidas quando a veracidade dos dados hemodinâmicos de pouca ou nenhuma irreversibilidade da HP obtidas no cateterismo cardíaco pré-operatório comparativamente à avaliação na sala de operações, nos momentos que antecedem ao implante do enxerto. O impacto farmacológico foi contundente, a ponto de todos os pacientes que tinham indicação para técnica heterotópica terem sido transplantados ortotopicamente, com resultados consistentes a curto e a longo prazos.
Outro aspecto importante deste trabalho é a estratégia de estabelecer linearidade de peso/superfície corporal doador/receptor do órgão doado, viabilizando assim a aplicação de uma ou de outra técnica cirúrgica conforme o perfil pressórico de cada caso.
CONCLUSÃO
A avaliação hemodinâmica com NS nos momentos que antecedem ao implante do coração doado demonstrou resolutividade, ensejando aplicação de metodologia cirúrgica adequada a pacientes portadores de HP elevada e pouco responsiva, sendo a simplicidade e originalidade alguns dos seus tributos.
REFERÊNCIAS
1. Griepp RB, Stinson EB, Dong E Jr, Clark DA, Shumway NE. Determinants of operative risk in human transplantation. Am J Surg. 1971;122(2):192-7. [MedLine]
2. Pennock JL, Oyer PE, Reitz BA, Jamieson SW, Bieber CP, Wallwork J, et al. Cardiac transplantation in perspective for the future. Survival, complications, rehabilitation, and cost. J Thorac Cardiovasc Surg. 1982,83(2):168-77. [MedLine]
3. Stinson EB, Griepp RB, Schroeder JS, Dong E Jr, Shunway NE. Hemodynamic observations one and two years after cardiac transplantation in man. Circulation. 1972;45(6):1183-94. [MedLine]
4. Bhatia SJ, Kirshenbaum JM, Shemin RJ, Cohn LH, Collins JJ, Di Sesa VJ, et al. Time course of resolution of pulmonary hypertension and right ventricular remodeling after orthotopic cardic transplantation. Circulation. 1987;76(4):819-26. [MedLine]
5. Kawaguchi A, Gandjbakhch I, Pavie A, Bors V, Muneretto C, Leger P, et al. Cardiac transplant recipients with preoperative pulmonary hypertension. Evolution of pulmonary hemodynamics and surgical options. Circulation. 1989;80(5 Pt 2):III90-6. [MedLine]
6.Addonizio LJ, Gersony WM, Robbins RC, Drusin RE, Smith CR, Reison DS, et al. Elevated pulmonary vascular resistance and cardiac transplantation. Circulation. 1987;76(5 Pt 2):V52-5. [MedLine]
7. Knapp E, Gmeiner R. Reduction of pulmonary hypertension by nitroprusside. Int J Clin Pharmacol Biopharm. 1977;15(2):75-80. [MedLine]
8. Chen JM, Levin HR, Michler RE, Prusmack CJ, Rose EA, Aaronson KD. Reevaluating the significance of pulmonary hypertension before cardiac transplantation: determination of optimal thresholds and quantification of the effect of reversibility on perioperative mortality. J Thorac Cardiovasc Surg. 1997;114(4):627-34. [MedLine]
9. O'Connell JB, Bourge RC, Constanzo-Nordin MR, Driscoll DJ, Morgan JP, Rose EA, et al. Cardiac transplantation: recipient selection, donor procurement, and medical follow up. A statement for health professionals from the Committee on Cardiac Transplantation of the Council on Clinical Cardiology, American Heart Association. Circulation. 1992;86(3):1061-79. [MedLine]
10. Mudge GH, Goldstein S, Addonizio LJ, Caplan A, Mancini D, Levine TB, et al. 24th Bethesda conference: Cardiac transplantation. Task Force 3: Recipient guidelines/prioritization. J Am Coll Cardiol. 1993;22(1):21-31. [MedLine]
11. Klotz S, Deng MC, Hanafy D, Schmid C, Stypmann J, Schmidt C, et al. Reversible pulmonary hypertension in heart transplant candidates: pretransplant evaluation and ontcome after orthotopic heart transplantation. Eur J Heart Fail. 2003;5(5):645-53. [MedLine]
12. Tenderich G, Koerner MM, Stuettgen B, Hornik L, Mirow N, Morshuis M, et al. Does preexisting elevated pulmonary vascular resistance (transpulmonary gradient > 15 mmHg or > 5 wood) predict early and long-term results after orthotopic heart transplantation? Transplant Proc. 1998;30(4):1130-1. [MedLine]
13. Stobierska-Dzierzek B, Awad H, Michler RE. The evolving management of acute right-sided heart failure in cardiac transplant recipients. J Am Coll Cardiol. 2001;38(4):923-31. [MedLine]
14. Birks EJ, Yacoub MH, Anyanwu A, Smith RR, Banner NR, Khaghani A. Transplantation using hearts from primary pulmonary hypertensive donors for recipients with a high pulmonary vascular resistance. J Heart Lung Transplant. 2004;23(12):1339-44. [MedLine]
15. Chang PP, Longenecker JC, Wang NY, Baughman KL, Conte JV, Hare JM, et al. Mild vs severe pulmonary hypertension before heart transplantation: different effects on posttransplantation pulmonary hypertension and mortality. J Heart Lung Transplant. 2005;24(8):998-1007. [MedLine]
16. Novitzky D, Cooper DK, Barnard CN. The surgical technique of heterotopic heart transplantation. Ann Thorac Surg. 1983;36(4):476-82. [MedLine]
17. Silva JP, Baumgratz JF, Vila JHA, Canêo LF. Transplante cardíaco heterotópico. Rev Soc Cardiol Estado de São Paulo. 1995;5(6):707-13.
18. Bocchi AE, Fiorelli A, Moreira LF, Bacal F. I Diretrizes da Sociedade Brasileira de Cardiologia para Transplante Cardíaco. Arq Bras Cardiol. 1999;73(Suppl 8):6-11. [MedLine]
19. Costard-Jäckle A, Fowler MB. Influence of preoperative pulmonary artery pressure on mortality after heart transplantation: testing of potential reversibility of pulmonary hypertension with nitroprusside is useful in defining a high risk group. J Am Coll Cardiol. 1992;19(1):48-54. [MedLine]
20. Mehra MR, Kobashigawa J, Starling R, Russell S, Uber PA, Parameshwar J, et al. Listing criteria for heart transplantation: International Society for Heart and Lung Transplantation guidelines for the care of cardiac transplant candidates 2006. J Heart Lung Transplant. 2006;25(9):1024-42. [MedLine]
21. Dinkhuysen JJ. Transplante cardíaco ortotópico bicaval/bipulmonar. Rev Bras Cir Cardiovasc.2003;18(3):268-72. Visualizar artigo
22. Butler J, Stankewicz MA, Wu J, Chomsky DB, Howser RL, Khadim G, et al. Pre-transplant reversible pulmonary hypertension predicts higher risk for mortality after cardiac transplantation. J Heart Lung Transplant. 2005;24(2):170-7. [MedLine]
23. Lindelöw B, Andersson B, Waagstein F, Bergh CH. High and low pulmonary vascular resistance in heart transplant candidates. A 5-year follow-up after heart transplantation shows continuous reduction in resistance and no difference in complication rate. Eur Heart J. 1999;20(2):148-56. [MedLine]
24. Goland S, Czer LS, Kass RM, De Robertis MA, Mirocha J, Coleman B, et al. Pre-existing pulmonary hypertension in patients with end-stage heart failure: impact on clinical outcome and hemodynamic follow-up after orthotopic heart transplantation. J Heart Lung Transplant. 2007;26(4):312-8. [MedLine]
25. Drakos SG, Kfoury AG, Gilbert EM, Horne BD, Long JW, Stringham JC, et al. Effect of reversible pulmonary hypertension on outcomes after heart transplantation. J Heart Lung Transplant. 2007;26(4):319-23. [MedLine]
26. Delgado JF, Gomes - Sanchez MA, De LA Saenz cc, et al. Impacto of mild pulmonary hypertension on mortality and pulmonary artery pressure profile after heart transplantation. J Heart Lung Transplant 2001;20:942-8 [MedLine]
Article receive on quarta-feira, 3 de março de 2010



 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license