INTRODUÇÃO
O pericárdio bovino preservado em glutaraldeído é um dos tecidos biológicos mais amplamente utilizados na forma de remendo em cirurgia cardiovascular. Nesta forma tem sido utilizado para correção de inúmeras cardiopatias como substituto das paredes atrial, ventricular, arterial e venosa e para reconstrução do saco pericárdico (1-34). É interessante observar que, apesar de amplamente utilizado, existem poucos relatos de insucessos clínicos decorrentes da sua disfunção. Foram descritas disfunções quando utilizado a nível atrial, nas operações de Mustard (11) e Senning (35), e como substituto pericárdico (36-39). Este resultado constrasta com o apresentado quando utilizado para confecção de prótese valvular, principalmente a calcificação. Esta diferença de comportamento e os trabalhos experimentais de GABBAY (38) (1984) e de BORTOLOTTI et al. (39) (1986) motivaram-nos a estudá-lo neste particular. Assim, esta pesquisa objetiva estudar, experimentalmente, o desempenho do pericárdio bovino preservado em glutaraldeído na forma de retalho utilizado como remendo no átrio esquerdo, aorta e pericárdio.
MATERIAL E MÉTODOS
Foram utilizados 21 cães adultos, sem raças definidas, com peso variando entre 11 kg e 35 kg. Nestes cães foram implantados retalhos padronizados de pericárdio bovino preservado em glutaraldeído, recortados com auxílio de um molde específico.
Os retalhos de forma elíptica medindo 1,5 cm no maior eixo e 1,0 cm no menor foram implantados para substituir parcialmente as paredes do átrio esquerdo, da aorta torácica e do pericárdio. As operações foram realizadas através de uma pequena toracotomia esquerda com os cães sob efeito de anestesia geral com intubação orotraqueal e ventilação mecânica controlada. O pericárdio foi aberto paralelamente ao nervo frênico, a parede atrial esquerda pinçada tangencialmente com uma pinça de Derra. Na parede atrial delimitada pela pinça cirúrgica procedeu-se a uma atriotomia de 1,5 cm de comprimento. A brecha resultante foi fechada com o retalho padronizado suturado às bordas da incisão com sutura contínua de Polipropilene 5-0, com a superfície lisa voltada para o interior do átrio esquerdo. O mesmo procedimento foi realizado na aorta descendente. O pericárdio foi fechado com pontos separados de algodão 2-0 sendo deixada uma abertura de 1,5 cm de comprimento na extremidade da pericardiotomia próxima ao diafragma, que foi fechada com o retalho padronizado suturado, com a superfície lisa voltada para o interior do pericárdio, nas bordas da incisão com pontos contínuos de Polipropilene 5-0 (Figura 1).

Fig. 1 - Ilustração mostrando a operação com os remendos atrial, aórtico e pericárdico concluídos.
Estes cães foram transferidos para um canil onde receberam os cuidados necessários habituais. Em diferentes períodos do pós-operatório foram reoperados. Após minuciosa descrição do achado operatório foram sacrificados com injeção endovenosa de cloreto de potássio à 19,1%. As peças com os respectivos remendos foram retiradas em bloco e armazenadas em solução de formaldeído.
No estudo macroscópico procurou-se quantificar, subjetivamente, as aderências do retalho com as estruturas vizinhas. Dependendo da dificuldade de se conseguir um plano de clivagem entre as estruturas, foi considerado: 0, +, ++ e +++ na ausência ou presença de mínima, moderada ou intensa aderência, respectivamente. Além da aderência, considerou-se a área de remendo que cada retalho promoveu. Para esta avaliação, a área dos remendos foi mantida fotocopiando cada peça. Os limites dos remendos, vistos pela face interna do átrio esquerdo, da aorta e do pericárdio, foram demarcados. Estas demarcações foram transferidas para uma transparência de retroprojetor e as áreas calculadas utilizando os recursos técnicos de um aparelho de tomografia computadorizada. (Figura 2).


Fig. 2 - A) Fotografia da transparência de retroprojetor com limites dos remendos demarcados; B) Fotografia do monitor do aparelho de tomografia mostrando a mensuração da área do remendo aórtico.
Para o estudo microscópico, as peças foram emblocadas em parafina, submetidas a 16 cortes intercalados de 5 a 8 micras e as lâminas coradas pela hematoxilina-eosina, tricrômico de Masson e pelo método de Verhoeff.
Para a avaliação evolutiva do desempenho do retalho de pericárdio bovino, os cães foram subdivididos em 3 grupos dependendo da época da reoperação e sacrifício, assim caracterizados: G1 constituído de 6 cães reoperados e sacrificados entre 33 e 43 dias de pós-operatório; G2 de 7 cães reoperados e sacrificados entre 120 e 165 dias de pós-operatório e G3 com 8 cães reoperados entre 225 e 305 dias de pós-operatório.
Para análise dos resultados foram utilizados testes não paramétricos, levando-se em conta a natureza das distribuições dos valores das variáveis ou da variabilidade das medidas efetuadas. Foram aplicados os seguintes testes:
1) Análise de variância, por postos, de Friedman com o objetivo de comparar, para cada cão, os valores das variáveis no átrio esquerdo, aorta e no pericárdio. A análise foi aplicada em separado para os Grupos 1, 2 e 3. Quando mostrou diferença significante, foi complementada pelo teste de comparações múltiplas.
2) Análise de variância, por postos, de Kruskal-Wallis com a finalidade de comparar os três grupos estudados em relação aos valores das variáveis consideradas. Esta análise foi aplicada em separado para o átrio esquerdo, aorta e pericárdio. Quando mostrou diferença significante, foi complementada pelo teste de comparações múltiplas.
3) Teste de Wilcoxon para duas amostras não independentes quando se comparou átrio esquerdo e aorta em relação à espessura da fibrose de aposição interna.
Em todos os testes fixou-se em 0,05 (Alfa < ou = 0,05) o nível para a rejeição da hipótese de nulidade, assinalando-se com um asterisco os valores significantes.
RESULTADOS
1) Imediato
Todos os cães suportaram bem as operações. Não ocorreu óbito intra-operatório. Uma intercorrência comum foi a presença de fibrilação atrial durante a manipulação atrial com reversão espontânea com o despinçamento do átrio esquerdo.
O pericárdio bovino mostrou-se de fácil manuseio. Permitiu a passagem da agulha do fio de Polipropilene sem muita resistência. Sua maleabilidade possibilitou, além da identificação das bordas da incisão, uma boa adaptação às estruturas às quais foi suturado, conferindo à estrutura um caráter hemostático. A perda sangüínea ainda foi minimizada pela impermeabilidade do material, o que evita o porejamento sangüíneo.
Um cão (4,76%) foi reoperado por deiscência total da ferida operatória. Três (14,2%) apresentaram infecção da ferida operatória.
2) Achado na Reoperação e Sacrifício.
2.1 Macroscopia
Independentemente da época da reoperação, foram encontradas na totalidade dos casos aderências relacionadas à face rugosa do retalho. Os retalhos implantados na aorta e no pericárdio aderiram ao pulmão, enquanto os atriais à lâmina parietal do pericárdio. Um comportamento diferente foi observado na face lisa do retalho do pericárdio bovino implantado no pericárdio. Este apresentava-se praticamente livre de aderências na quase totalidade dos casos (Figura 3 e Tabela 1).


Fig. 3 - A) Fotografia do remendo atrial; B) Fotografia dos remendos aórtico, pericárdico e atrial.

Macroscopicamente, enquanto os remendos do pericárdio e da aorta apresentavam-se com os limites bem definidos, com a espessura relativamente preservada, o atrial mostrava-se espessado com os limites pouco nítidos, com aspecto mais grosseiro (Figura 4). As áreas dos remendos atriais mostraram-se menores do que as dos remendos aórticos e pericárdicos para todos os grupos; entretanto, esta diferença não foi estatisticamente significante entre os remendos atriais e pericárdicos para os cães do G1 (Tabela 2). A análise de Kruskal-Wallis demonstrou que os remendos atriais diminuíram, enquanto os aórticos e pericárdicos mantiveram-se inalterados com o tempo.
Dois cães (números 7 e 10) apresentaram grandes trombos aderidos à face lisa dos retalhos atriais.

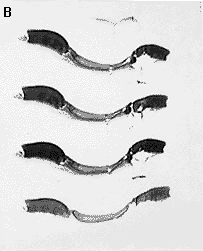

Fig. 4 - A) Átrio. Continuidade estrutural entre o retalho (centro) e parede do átrio; aumento 2x tricomia de Masson; B) Aorta. Continuidade estrutural entre o retalho (centro) e a aorta; aumento 2x Verhoef; C) Pericárdio. Retalho de pericárdio bovino com a superfície lisa livre; aumento 2x tricômia de Masson.

2.2 Microscopia
O exame anatomopatológico não evidenciou, nenhuma das 63 peças, alterações da estrutura do retalho de pericárdio bovino. Mostrava-se constituído de tecido conectivo colágeno fibroelástico denso e modelado com as fibras dispostas paralelamente em arranjo compacto. Não foram observados fenômenos degenerativos, inflamatórios ou metaplásticos. O retalho apresentava trajeto retilíneo ou levemente arqueado quando implantado no pericárdio ou na aorta, enquanto no átrio esquerdo mostrava-se ondulado ou sanfonado (Figura 4).
O retalho integrava-se às estruturas através de delgado feixe de tecido conjuntivo colágeno, que também envolvia os fios de suturas.
A coaptação do retalho com a aorta e o pericárdio ocorreu por aposição ou leve superposição das bordas (Figura 5).
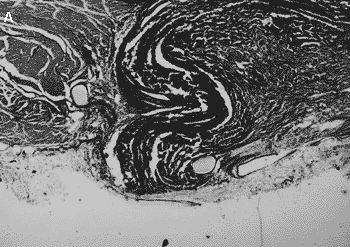

Fig. 5 - A) Átrio. Coaptação das bordas por invaginação da borda do retalho de pericárdio. Tecido de integração representado por faixa de tecido conjuntivo colágeno, fio de sutura envolto por círculo uniforme de tecido conjuntivo colágeno; aumento 40x, Verhoeff; B) Átrio. O retalho, abaixo e à direita, está coaptado ao átrio com invaginação da borda. O tecido de integração está representado por delgada faixa de tecido conjuntivo colágeno. A fibrose de aposição interna faz continuidade com parede atrial; aumento 40x. Hematoxilina-eosina.
No retalho do pericárdio implantado no pericárdio, além do tecido de integração foi observada regeneração das células mesoteliais na zona de coaptação e presença de tecido pulmonar ou tecido adiposo aderidos à sua face rugosa.
Os retalhos de pericárdio bovino implantados no átrio esquerdo e na aorta apresentaram um comportamento distinto do implantado no pericárdio. Apresentaram na superfície lisa, em contato com a corrente circulatória, a deposição de tecido conjuntivo fibroso. Este tecido, aqui denominado de fibrose de aposição interna (Figura 6) mostrou, por sua vez, um comportamento diferenciado entre o átrio esquerdo e a aorta. Mostrou-se mais espesso no átrio esquerdo do que na aorta. Esta diferença de espessura foi estatisticamente significante para os cães do Grupos 1 e 2 (Tabela 3). Na fibrose de aposição interna foi observada calcificação. Esta ocorreu de forma mais grosseira no átrio esquerdo. Na aorta apresentou neoformação de tecido elástico característico, que não foi observado no átrio esquerdo. Tanto a calcificação como a neoformação elástica apresentaram nítida relação com o tempo de implante (Figura 7 e Tabela 4).


Fig. 6 - Pericárdio.A) Retalho de pericárdio bovino com a estrutura preservada e a superfície lisa livre, superiormente. Observam-se as fibras elásticas em preto, tecido adiposo aderido na superfície rugosa; aumento 35x. Verhoeff; B) Face lisa do retalho de pericárdio bovino recoberta pelo tecido de aposição interna. A estrutura do retalho normal, superiormente observa-se o tecido elástico neoformado; aumento 100x. Verhoeff.

Fig. 7 - Aorta. Fibrose de aposição interna em grau mínimo, com foco circunscrito de metaplasia ósteo-cartilaginosa, à direita, e faixa contínua de tecido elástico neoformado, margem superior. O retalho de pericárdio bovino, abaixo, está com a estrutura conservada; aumento 35x. Verhoeff.


COMENTÁRIOS
O pericárdio bovino foi introduzido na cirurgia cardiovascular por IONESCU et al (40), em 1972, e difundido entre nós por BRAILE et al (6), a partir de 1983. Embora conhecido seu desempenho na confecção de próteses vasculares (IONESCU & TANDON (19), em 1977, foi pouco estudado quando utilizado como remendo vascular. A ampla utilização do reparo de pericárdio como remendo contrasta, contudo, com o pequeno número de estudos experimentais a este respeito. Julgamos, assim, oportuno o estudo deste material biológico submetido a diferentes condições de implante: no átrio, aorta e pericárdio.
Quanto ao resultado intra-operatório, de ausência de óbitos, julgamos ser em parte imputado às características do retalho, pois seu fácil manuseio e maleabilidade permitiram a confecção do remendo em condições cirúrgicas bastante satisfatórias.
A ausência de mortalidade tardia ou complicações clínicas demostram a pertinência da utilização do retalho como remendo em cirurgia cardíaca.
Nítida diferença de comportamento foi observada entre as faces lisa e rugosa dos retalhos. Nas reoperações todos os cães apresentavam, em maior ou menor intensidade, a face rugosa dos retalhos aderida às estruturas vizinhas, enquanto a face lisa implantada no pericárdio mostrava-se livre na maioria dos casos. Esta monotonia do resultado nos deu uma boa impressão quanto à possibilidade da sua utilização como substituto pericárdico. Esses resultados foram compatíveis com os obtidos por GALLO et al. (17), em 1978; MEUS et al. (43), em 1983, e BORTOLOTTI et al. (39), em 1986. A excelência do resultado experimental confronta com os resultados clínicos do retalho de pericárdio bovino como substituto pericárdico, que SKINNER et al. (37), em 1984; GALLO et al. (17), em 1985; OPIE et al. (44), em 1986, e ENG et al. (14), em 1989, relataram do encontro de intensa reação epicárdica, fibrose e aderências imputadas à presença deste como substituto pericárdico.
Esta discrepância de resultados motivou GABBAY et al. (53), em 1989, a estudar a gênese das aderências pericárdicas. Observaram importante formação de aderências quando o animal era submetido à ação da circulação extracorpórea. Baseados nos trabalhos de GERVIN et al. (18), em 1973, nos quais descreveram a diminuição da atividade fibrinolítica do pericárdio quando submetido a algum trauma, sugeriram este mesmo mecanismo para a gênese das aderências - diminuição da atividade fibrinolítica do pericárdio por ação da circulação extracorpórea. Esta alteração da atividade fibrinolítica foi constatada clinicamente por NKERE et al. (45), em 1973. Observaram diminuição do fator de ativação tissular, do plasminogênio concomitante à alteração inflamatória do mesotélio pericárdico. Segundo CLIFF et al (10), em 1973, e ROBISON et al. (46), em 1983, dois importantes fatores devem ser considerados na gênese das aderências pericárdicas: a diminuição da atividade fibrinolítica e a presença de sangue no pericárdio, ambas presentes simultaneamente. Nesta pesquisa o pericárdio foi amplamente aberto, reparado e foi comum a presença de sangue extravasado da sutura do retalho atrial; mesmo assim, a quantidade de aderências foi mínima.
Devemos salientar que foram, de regra, encontradas aderências entre a face rugosa do retalho implantado no átrio esquerdo com o pericárdio do cão, sugerindo um comportamento diferente das duas faces do retalho, o que sinaliza a presença de um outro fator, relacionado ao retalho, além dos indicados na gênese das aderências pericárdicas.
O bom resultado quanto à alteração estrutural, encolhimento, fibrose e calcificação sugerem a possibilidade da utilização clínica do pericárdio bovino como substituto pericárdico. Ressaltamos, por outro lado, a necessidade de definição da importância da circulação extracorpórea na gênese das aderências pericárdicas.
Macroscopicamente os remendos, também, apresentaram importantes diferenças. Enquanto na aorta e no pericárdio os limites eram nítidos e com a forma original pouco alterada, no átrio esquerdo o remendo apresentava aspecto mais grosseiro, espessado e com os limites mal definidos. A área dos remendos atriais era menor do que a pericárdica e aórtica, apesar da não significância estatística entre os remendos atriais e pericárdios para os cães do Grupo 1. Além desta diferença de área, a análise de Kurskal-Wallis demonstrou que a área dos remendos atriais diminuiu com o tempo (Tabela 2).
Os fatores que poderiam influir para esta diferença de área são: a diferença de tensão aplicada ao retalho e a forma de coaptação do retalho com as estruturas. O retalho implantado no átrio esquerdo estava submetido a um regime de baixa tensão e, em decorrência, o trajeto do retalho era ondulado ou sanfonado (Figura 9), enquanto o implantado na aorta ou pericárdio, devido à maior tensão aplicada, apresentava-se arqueado ou retilíneo. Em conseqüência desta diferença de trajeto, a área foi maior ou menor. A forma de coaptação também pode ter influído na área, posto que, para o pericárdio e aorta, a coaptação ocorreu por aposição ou leve superposição, enquanto para o átrio esquerdo ocorreu por invaginação ou superposição das estruturas.
Quanto aos aspectos microscópicos, independentemente da posição do implante, não ocorreu alteração da estrutura do retalho. Não foram evidenciadas as alterações descritas por FERRANS et al. (47), em 1980; LEVY et al. (48), em 1983, e SHOEN et al. (49), em 1985, para as biopróteses de porco e as descritas por ROSSI et al. (50), em 1986; FERRANS et al. (51), em 1987, e DAHM et al. (52), em 1990, para o pericárdio bovino. Estes relataram o encontro de degeneração das fibras colágenas decorrentes de infiltração inflamatória com invasão linfo-histiocitária e calcificação. Nesta pesquisa este não comprometimento da estrutura do retalho pode estar relacionado ao fato de o contato com a corrente sangüínea ocorrer somente pela face lisa. De modo diferente, nas próteses valvulares e nos retalhos implantados no subcutâneo, que foi a forma estudada pelos autores citados, ocorreu pelas duas faces do retalho. Nesta face do retalho ocorreu a deposição do tecido de aposição interna, o que, aparentemente, isolou o retalho da ação dos elementos sangüíneos por um tempo mais prolongado. Todos os retalhos implantados em átrio esquerdo e aorta apresentaram esta camada no 33º dia de pós-operatório.
Relevante foi o fato de ROSSI et al. (50), em 1986, pesquisando o pericárdio com as mesmas especificações implantado em subcutâneo de ratos, terem encontrado calcificação na estrutura do retalho. Descreveram calcificação do retalho a partir de 24 horas de implante e progressivamente maior com o tempo. Não relataram a presença do tecido de aposição interna. Nesta pesquisa este tecido fibroso também não foi encontrado nos retalhos implantados no pericárdio - sem contato direto com a corrente sangüínea. Assim, em consonância com GABBAY et al. (53), em 1984, e BORTOLOTTI et al. (39), em 1986, estes dados indicam que o comportamento do pericárdio bovino parece sofrer influência do local de implante e do direto contato com o sangue. Nesta pesquisa a calcificação ocorreu na camada de fibrose de aposição interna. A impressão que se tem é que o perfeito tratamento torna o pericárdio bovino alheio aos fenômenos da resposta ao implante de um tecido vivo. O retalho desencadeia uma cicatrização, que ocorre na superfície sem comprometer, entretanto, sua estrutura. Este tecido de cicatrização, juntamente com o retalho, constituem o remendo cirúrgico. Este sim, sujeito à degeneração própria dos tecidos biológicos, como por exemplo a calcificação observada no tecido de aposição interna.
O pericárdio integrou-se às estruturas com a mesma forma de integração que o fio de sutura (Prolipropilene), que é um material sintético. Esta forma de integração nos permite, mais uma vez, inferir que o pericárdio bovino, desta forma tratado e nesta condição implantado, funcionou como um material inerte.
A fibrose de aposição interna estava presente na totalidade dos casos dos retalhos implantados no átrio esquerdo e na aorta. Esta fibrose apresentava-se mais espessada no átrio do que no ventrículo. A análise estatística mostrou significância estatística para os Grupos 1 e 2, e que esta fibrose não aumentou com o tempo.
Tecido fibroso com as mesmas características foi descrito recobrindo as duas faces dos folhetos das próteses valvulares (ISHIHARA et al. (54), em 1981) e com neoíntima nos condutos vasculares (FERRANS et al. (51), em 1987). Esta fibrose não foi observada em nenhum caso de retalho implantado no pericárdio. Este fato sugere que este tecido tem sua origem da organização fibrosa de elementos sangüíneos depositados sobre a superfície lisa do retalho. Esta camada sofre as mesmas alterações descritas por ARBUSTINI et al. (55), em 1983, no tecido fibroso que recobre os folhetos das próteses de tecidos biológicos - metaplasia cartilaginosa e ossificação. Esta metaplasia representa a transformação de fibroblastos em osteoblastos. Esta calcificação, como mostra a Tabela 4, apresentou nítida relação com o tempo. Vale lembrar que a calcificação não ocorreu na estrutura do retalho.
Outra alteração marcante sofrida pelo tecido de aposição interna foi a neoformação elástica encontrada nos remendos aórticos. Tal como a calcificação, esta apresentou nítida relação com o tempo. Parece representar uma adaptação morfofuncional do plano de fibrose de aposição interna relacionada com a função elástica da aorta, já que não foi observada em nenhum caso nos retalhos atriais. Esta neoformação pode ser propiciada pela elasticidade encontrada no retalho de pericárdio bovino.
O bom resultado obtido nesta pesquisa quanto a alteração estrutural, encolhimento, fibrose e calcificação sugere a possibilidade da utilização clínica do pericárdio bovino preservado em glutaraldeído como substituto das paredes aórtica e pericárdica; entretanto, no átrio esquerdo seu desempenho é inferior, posto que encolhe e propiciou a formação de trombos.
REFERÊNCIAS BIBLIOGRÁFICAS
1 Abdulali S A, Silverton N P, Yakirevich V S, Ionescu M I - Right ventricular outflow tract reconstruction with a bovine pericardial monocusp patch. J Thorac Cardiovasc Surg 1985;89: 764-71.
[ Medline ]
2 Arnoni A S, Falcão H C B, Oliveira J B et al. - Tratamento cirúrgico do abscesso aórtico com descontinuidade ventrículo esquerdo - aorta em endocardite infecciosa. Rev Bras Cir Cardiovasc 1987; 1: 53-60.
3 Barbero-Marcial M, Riso A A, Verginelli G, Pileggi F, Jatene A D - Técnica para correção de "truncus arteriosus" tipos I e II sem condutos extracardíacos. Rev Bras Cir Cardiovasc 1989; 4: 1-8.
[ Lilacs ]
4 Bongiovani H L, Ribeiro P J F, Évora P R B, Brasil C F, Reis C L, Sgarbieri R N - Plastia valvar aórtica por ampliação de válvula com pericárdio bovino: nota prévia. Rev Bras Cir Cardiovasc 1988; 3: 130-3.
[ Lilacs ]
5 Braile D M - Prótese valvular de pericárdio bovino: desenvolvimento e aplicação clínica em posição mitral [Tese. Doutorado] São Paulo: Escola Paulista de Medicina da Universidade Federal de São Paulo, 1990. 110p.
6 Braile D B, Bilaqui A, Ardito R V et al - Alargamento da raiz da aorta com "patch" de pericárdio bovino preservado em glutaraldeído. Arq Bras Cardiol 1983; 41: 289-96.
[ Medline ] [ Lilacs ]
7 Braile D M, Bilaqui A, Ardito R V et al. - Prótese de pericárdio bovino: 44 meses em 164 pacientes. In: Anais do 9º Congresso Nacional de Cirurgia Cardíaca. São Paulo, SP: Sociedade Brasileira de Cirurgia Cardiovascular, 1981.
8 Braile D M, Mustafá R M, Santos J L V et al. - Correção da geometria do ventrículo esquerdo com prótese semi-rígida de pericárdio bovino. Rev Bras Cir Cardiovasc 1991; 6: 109-15.
[ Lilacs ]
9 Casagrande I S J, Puig L B, Salles C A, Ricardo O P - Tubo de pericárdio bovino corrugado recoberto com Dacron: novo modelo de prótese vascular. Rev Col Bras Cir 1988; 15: 153 (Resumo).
10 Cliff W J, Grobety J, Ryan G B - Postoperative pericardial adhesions: the role of mild serosal injury and pilled blood. J Thorac Cardiovasc Surg 1973; 65: 744-50.
[ Medline ]
11 Cochran R P & Mc Gough E C - Bovine pericardial: a source of pulmonary venous obstruction in the Mustard operation. Ann Thorac Surg 1987; 44: 552-3.
12 Crawford F A, Sade R M, Spinale F - Bovine pericardium for correction of congenital heart defects. Ann Thorac Surg 1986; 41: 602-5.
[ Medline ]
13 Dallan L A, Oliveira S A, Ramires J A, Sabino Neto A, Verginelli G, Jatene A D - Tratamento cirúrgico da comunicação interventricular pós infarto agudo do miocárdio: conduta atual. Rev Bras Cir Cardiovasc 1989; 4: 64-74.
[ Lilacs ]
14 Eng J, Ravichandran P S, Abbott C R, Kay P H, Murday A J, Shreiti I - Reoperation after pericardial closure with bovine pericardium. Ann Thorac Surg 1989; 48: 813-5.
[ Medline ]
15 Évora P R B, Ribeiro P J F, Brasil J C F et al. - Experiência com dois tipos de técnicas para tratamento cirúrgico da insuficiência mitral: I. Prótese com preservação de elementos do sistema valvar. II. Plastia valvar com reconstrução e avanço da cúspide posterior. Rev Bras Cir Cardiovasc 1988; 3: 36-49.
[ Lilacs ]
16 Gabbay S, Guindy A M, Andrews J F, Amato J J, Seaver P, Khan M Y - New outlook on pericardial substitution after open heart operations. Ann Thorac Surg 1989; 48: 803-12.
[ Medline ]
17 Gallo J I, Artinano E, Duran C M G - Clinical experience with glutaraldehyde-preserved heterologous pericardium for the closure of the pericardium after open heart surgery. J Thorac Cardiovasc Surg 1982; 30: 306-9.
18 Gervin A S, Jacobs G, Hufnagel H V, Mason K G - Surgical trauma and pericardial fibrinolytic activity. Ann Surg 1975; 41: 225-6.
19 Ionescu M I & Tandon A P - Heart valve replacement with Ionescu-Shiley pericardial xenograft. J Thorac Cardiovasc Surg 1977; 73: 31-42.
[ Medline ]
20 Leão L E V, Succi J E, Gerola L R, Lima P R, Braile D M, Gimenes A C - Sistematização das reoperações sobre a valva mitral. Rev Soc Cardiol Estado de São Paulo 1992; 2: 72.
21 Loures D R, Ferreira M J A, Almeida R S et al. - Aneurisma adquirido de aorta ascendente em criança. Rev Bras Cir Cardiovasc 1989; 4: 94-9.
[ Lilacs ]
22 Lukács L, Zaborszky B, Sórkozy K, Órvay A - Reconstruction of the right ventricular outflow tract with bovine pericardial monocusp patch. Tex. Heart Inst J 1984; 11: 234-7.
23 Mills S A & Salem W - Complications associated with the use of heterologous bovine pericardial closure. J Thorac Cardiovasc Surg 1986; 92: 446-54.
[ Medline ]
24 Moraes C R & Rodrigues J V - Conduto valvulado de pericárdio bovino: relato de caso. Arq Bras Cardiol 1987; 43: 173-7.
25 Moraes C R, Rodrigues J V, Gomes C A et al. - Operação de Rastelli utilizando-se conduto valvulado de pericárdio bovino: experiência inicial. Rev Bras Cir Cardiovasc 1988; 3: 84-92.
[ Lilacs ]
26 Moraes C R, Rodrigues J V, Gomes C A et al. - Coarctação da aorta: resultados de cirurgia e análise crítica de diversas técnicas. Rev Bras Cir Cardiovasc 1989; 4: 168-72.
[ Lilacs ]
27 Palma H, Juliano J A, Cal R G R et al. - Tratamento dos aneurismas da aorta descendente por endoprótese (tromba de elefante). Rev Bras Cir Cardiovasc 1989; 4: 190-4.
[ Lilacs ]
28 Pieracciani G, Carvalho J L, Jesus Filho A R et al. - Aneurismas não rotos dos seios de Valsalva com insuficiência aórtica e mitral: relato de caso. Rev Cir Cardiovasc 1989; 2: 25-9.
29 Revuelta J M, Ubago J L, Duran C M G - Composit pericardial monocusp patch for the reconstruction of rigth ventricular outflow tract: application in 7 patients. Thorac Cardiovasc Surg 1983; 31: 156-9.
30 Ribeiro P J, Bongiovani H L, Évora P R B - Plástia aórtica por ampliação de válvula(s) com pericárdio bovino. Rev Bras Cir Cardiovasc 1990; 5: 99-105.
[ Lilacs ]
31 Salles C A, Puig L B, Casagrande I S et al. - Crimped bovine pericardial conduit for arterial reconstruction. Eur J Cardiothorac Surg 1991; 5: 273-9.
[ Medline ]
32 Souza L C B, Chaccur P, Dinkhuysen J J et al. - Tratamento cirúrgico da lesão do óstio da coronária esquerda. Rev Bras Cir Cardiovasc 1988; 3: 182-8.
[ Lilacs ]
33 Wanderley Neto J, Torres L D F, Dourado G O et al. - Tratamento cirúrgico da ectasia anulo aórtica com tubo valvado. Rev Cir Cardiovasc 1989; 2: 37-41.
34 Yakirevich V S, Abdulali S A, Abbott C R, Ionescu M I - Reconstruction of pericardial sac with glutaraldehyde-preserved bovine pericardium. Tex. Heart Inst J 1984; 3: 238-42.
35 Bullaboy C - Bovine pericardium: another cautionary note. Ann Thorac Surg 1989; 48: 743. (Correspondence)
36 Gallo J J, Artinano E, Duran C G - Late clinical result with the use of heterologous pericardium for closure of the pericardial cavity. J Thorac Cardiovasc 1985; 89: 709-12.
37 Skinner J R, Kim H, Toon R S, Kongtahworn C, Phillips S J, Zeff R H - Inflammatóry epicardial reaction to processed bovine pericardium: case report. J Thorac Cardiovasc Surg 1984: 88: 789-91.
[ Medline ]
38 Gabbay S - The need for intensive study of pericardial substitution after open heart surgery. Transac ASAIO 1990; 36: 789-91.
39 Bortolotti U, Zussa C, Factor S, Frater R W M - Glutaraldehyde treated auto, homo and xenograft pericardium in atrial, mitral, aortic and pericardial applications. Life Support Systems 1986; 4: 148-50.
40 Ionescu M I, Smith D R, Sutherland T W, Wooler G H - Heart valve replacement with aortic heterografts. Ann Thorac Surg 1972; 13: 1-14.
[ Medline ]
41 Ionescu M I, Tandon A P, Macartney F J - Long-term sequential hemodynamic evaluation of right ventricular outflow tract reconstruction using a valve mechanism. Ann Thorac Surg 1979; 27: 426-34.
[ Medline ]
42 Gallo J I, Pomar J L, Artinano E, Val F, Duran C M G - Heterologous pericardium for the closure of pericardial defects. Ann Thorac Surg 1978; 26: 149-54.
[ Medline ]
43 Meus P J, Wernly J A, Campbell C D et al. - Long-term evaluation of pericardial substitutes. J Thorac Cardiovasc Surg 1983; 85: 54-8.
[ Medline ]
44 Opie J C, Larrieu A J, Cornelli I S - Pericardial substitutes: delayed reexploration and findings. Ann Thorac Surg 1987; 43: 383-5.
[ Medline ]
45 Nkere U U, Whawell S A, Thompson E M, Thompson J N, Taylor J N - Changes in pericardial morphology and fibrinolytic activity during cardiopulmonary bypass. J Thorac Cardiovasc Surg 1993; 106: 339-45.
[ Medline ]
46 Robison R J, Brown J W, Deschner W P, Highes B, King H - Prevention of pericardial adhesions with Dextran 70. Ann Thorac Surg 1984; 37: 488-90.
[ Medline ]
47 Ferrans V J, Boyce S W, Billingham M E, Jones M, Isihara T, Roberts W C - Calcific deposits in porcine prostheses: structure and pathogenesis. Am J Cardiol 1980; 46: 721-34.
48 Levy R J, Wolfrum J, Schoen F J, Hawley M, Lund S A - Inhibition of calcification of bioprosthetic heart valve by local controlled-release diphosphonate. Science 1985; 228: 190-1.
49 Schoen F J, Levy R J, Nelson A C, Bernhard W F, Nashef A, Hawley M - Onset and progression of experimental bioprosthetic heart valve calcification. Lab Invest 1985; 52: 523-32.
[ Medline ]
50 Rossi M A, Braile D M, Teixeira M D R, Carillo C - Calcific degeneration of pericardial valvular xenografts implanted subcutaneously in rats. Int J Cardiol 1986; 12: 331-9.
[ Medline ]
51 Ferrans V J, Tomita Y, Hilbert S L, Jones M, Roberts W C - Pathology of bioprosthetic cardiac valves. Human Pathol 1987; 18: 586-95.
52 Dahn M, Lyman W D, Schewell A B, Factor S M, Frater R W M - Immugenicity of glutaraldehyde-tanned bovine pericardium. J Thorac Cardiovasc Surg 1990; 99: 1082-93.
53 Gabbay S, Bortolotti U, Factor S, Shore D F, Frater R W M - Calcification of implanted xenograft pericardium: influence of sitiun and function. J Thorac Cardiovasc Surg 1984; 87: 782-7.
[ Medline ]
54 Ishihara T, Ferrans V J, Jones M, Boyce S W, Roberts W C - Structure of parital pericardium and of unimplanted Ionescu-Shiley pericardial valvular bioprostheses. J Thorac Cardiovasc Surg 1981; 81: 747-57.
55 Arbustini E, Jones M, Ferrans V J - Formations of cartilage in bioprosthetic cardiac valve implanted in sheep: a morphologic study. Am J Cardiol 1983; 55: 632-43.
















 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license