Jeronimo Antonio Fortunato JúniorI; Marcelo Luiz PereiraII; André Luiz M. MartinsII; Daniele de Souza C. PereiraIII; Maria Evangelista PazIV; Luciana PaludoV; Alcides Branco FilhoVI; Branka MilosewichVII
DOI: 10.5935/1678-9741.20120006
RESUMO
INTRODUÇÃO: A cirurgia cardíaca minimamente invasiva e videoassistida (CCVA) tem aumentado em popularidade nos últimos 15 anos. As pequenas incisões têm sido associadas a um bom efeito estético e menor trauma cirúrgico, consequentemente, menor dor e rápida recuperação pós-operatória.
OBJETIVOS: Apresentar nossa casuística com CCVA, após 6 anos de uso do método.
MÉTODOS: Cento e trinta e seis pacientes foram submetidos à CCVA, após consentimento escrito, entre setembro de 2005 e outubro de 2011, sendo 50% do sexo masculino, com idade de 47,8 ± 15,4 anos, divididos em dois grupos: com circulação extracorpórea (CEC) (GcCEC=105 pacientes): valvopatia mitral (47/105), valvopatia aórtica (39/105) e cardiopatia congênita (19/105) e sem CEC (GsCEC=31 pacientes): ressincronização cardíaca (18/31), tumor cardíaco (4/31) e revascularização miocárdica minimamente invasiva (6/31). No GcCEC, foi realizada minitoracotomia direita (3 a 5 cm) e acesso femoral para canulação periférica.
RESULTADOS: No GcCEC, a média de dias em UTI (DUTI) e de internação hospitalar (DH) foi, respectivamente, 2,4 ± 4,5 dias e 5,0 ± 6,8 dias. Doze pacientes apresentaram complicações no pós-operatório e cinco (4,8%) foram a óbito. Noventa e três (88,6%) pacientes evoluíram sem intercorrências, foram extubados no centro cirúrgico, permanecendo 1,8 ± 0,9 DUTI e 3,6 ± 1,3 DH. No GsCEC, foram 1,3 ± 0,7 DUTI e 2,9 ± 1,4 DH, sem intercorrências ou óbitos.
CONCLUSÃO: Os resultados encontrados nesta casuística são comparáveis aos da literatura mundial e confirmam o método como opção à técnica convencional.
ABSTRACT
INTRODUÇÃO: A cirurgia cardíaca minimamente invasiva e videoassistida (CCVA) tem aumentado em popularidade nos últimos 15 anos. As pequenas incisões têm sido associadas a um bom efeito estético e menor trauma cirúrgico, consequentemente, menor dor e rápida recuperação pós-operatória.
OBJETIVOS: Apresentar nossa casuística com CCVA, após 6 anos de uso do método.
MÉTODOS: Cento e trinta e seis pacientes foram submetidos à CCVA, após consentimento escrito, entre setembro de 2005 e outubro de 2011, sendo 50% do sexo masculino, com idade de 47,8 ± 15,4 anos, divididos em dois grupos: com circulação extracorpórea (CEC) (GcCEC=105 pacientes): valvopatia mitral (47/105), valvopatia aórtica (39/105) e cardiopatia congênita (19/105) e sem CEC (GsCEC=31 pacientes): ressincronização cardíaca (18/31), tumor cardíaco (4/31) e revascularização miocárdica minimamente invasiva (6/31). No GcCEC, foi realizada minitoracotomia direita (3 a 5 cm) e acesso femoral para canulação periférica.
RESULTADOS: No GcCEC, a média de dias em UTI (DUTI) e de internação hospitalar (DH) foi, respectivamente, 2,4 ± 4,5 dias e 5,0 ± 6,8 dias. Doze pacientes apresentaram complicações no pós-operatório e cinco (4,8%) foram a óbito. Noventa e três (88,6%) pacientes evoluíram sem intercorrências, foram extubados no centro cirúrgico, permanecendo 1,8 ± 0,9 DUTI e 3,6 ± 1,3 DH. No GsCEC, foram 1,3 ± 0,7 DUTI e 2,9 ± 1,4 DH, sem intercorrências ou óbitos.
CONCLUSÃO: Os resultados encontrados nesta casuística são comparáveis aos da literatura mundial e confirmam o método como opção à técnica convencional.
CCVA: cirurgia cardíaca minimamente invasiva e videoassistida
CEC: circulação extracorpórea
DH: dias de internação hospitalar
DUTI: dias de internação em UTI
GcCEC: grupo com auxílio da circulação extracorpórea
GsCEC: grupo sem auxílio da circulação extracorpórea
UTI: unidade de terapia intensiva
TEE: ecocardiografia transesofágica
INTRODUÇÃO
A cirurgia cardíaca minimamente invasiva tem aumentado em popularidade nos últimos 15 anos. As pequenas incisões têm sido associadas a um bom efeito estético e menor trauma cirúrgico, consequentemente menor dor e rápida recuperação pós-operatória. Durante algum tempo, mesmo esses argumentos não atraiam a atenção da população médica. Com a maior divulgação da técnica e melhores resultados em relatos recentes, esse conceito vem se modificando. Os benefícios das mínimas incisões se sustentam principalmente com a confirmação da redução dos custos hospitalares, sem prejudicar os resultados já alcançados com esternotomia mediana [1-3].
Incorporando as técnicas minimamente invasivas, também nos últimos anos, os procedimentos endovasculares tomaram popularidade. Nesses exemplos, incluem-se as endopróteses de aorta, dispositivos para oclusão de fendas congênitas (Amplatzers) e os implantes transcateter de valva aórtica [4-8].
Mesmo assim, a esternotomia mediana ainda é o acesso tradicional para tratamento cirúrgico das doenças do coração, pois permite excelente controle de todas as estruturas cardíacas, afirmando-se como uma técnica segura e com baixa morbimortalidade.
Todas as opções cirúrgicas recentemente incorporadas têm demonstrado que a evolução tecnológica aliada à medicina tem grande valor científico e, apesar dos bons resultados já alcançados com os procedimentos convencionais, não devem ser desprezadas [9].
Neste trabalho, procuramos reunir todos os casos submetidos à cirurgia cardíaca em nossa instituição com intervenções minimamente invasivas e videoassistida (CCVA) e divulgar os resultados do período intra-hospitalar.
MÉTODOS
Cento e trinta e seis pacientes foram submetidos a CCVA, entre setembro de 2005 e outubro de 2011, depois de informados sobre o procedimento alternativo e assinado termo de consentimento esclarecido. Sessenta e oito (50%) pacientes eram do sexo masculino e a idade média foi de 47,8 ± 15,4 anos. Nesta casuística, com a intenção de permitir melhor homogeneização das doenças, os pacientes foram divididos em dois grupos: com auxílio da circulação extracorpórea (GcCEC) e sem emprego da CEC (GsCEC). Cento e cinco pacientes foram submetidos a cirurgia cardíaca com cardiotomia e CEC e os 31 pacientes restantes submetidos a procedimentos na periferia do coração, sem necessidade de cardiotomia.
No grupo GcCEC, 35% dos pacientes apresentavam valvopatia mitral, 29%, valvopatia aórtica e 14%, cardiopatia congênita. No grupo GsCEC, 18 (13%) pacientes apresentavam miocardiopatia dilatada e foram submetidos a terapia de ressincronização ventricular, três pacientes foram submetidos a correção de fístula coronário-pulmonar por toracoscopia (sem auxílio de CEC), quatro pacientes foram submetidos a ressecção endoscópica de tumor envolvendo o coração (3%) e seis foram submetidos a revascularização miocárdica minimamente invasiva com dissecção de artéria mamária interna esquerda através de toracoscopia (4%). Todas as características clínicas dos pacientes desta casuística foram incluídas na Tabela 1.
Avaliação ecocardiográfica, doppler vascular periférico, de aorta abdominal e de artérias carótidas foram realizados em todos os pacientes que necessitaram de CEC periférica. Coronariografia foi realizada nos pacientes que apresentavam risco cardiovascular compatível com a possibilidade de doença coronária. Foram excluídos do presente estudo pacientes que apresentavam concomitantemente insuficiência aórtica moderada a importante indicados para cirurgia mitral, doença vascular periférica grave com necessidade de CEC periférica, cirurgia torácica prévia do mesmo lado do procedimento cirúrgico, doença coronariana cirúrgica concomitante ou que optassem pela esternotomia mediana. Nos demais casos, a primeira opção foi sempre a CCVA.
No Grupo GcCEC, foi realizada minitoracotomia direita (3 a 5 cm), no 3º ou 4º espaço intercostal direito, conforme a doença aórtica ou atrioventricular envolvida e CEC periférica, realizada pelos vasos femorais (port-access technology) [10,11]. Toracoscopia esquerda foi procedida nos casos de ressincronização cardíaca, revascularização miocárdica ou em que foi necessário o mesmo acesso cirúrgico.
Ecocardiografia transesofágica (TEE) foi usada em todos os pacientes do GcCEC, tanto para introdução das cânulas arterial e venosa, como para acompanhamento e confirmação do resultado cirúrgico, valvar ou congênito.
Os instrumentais utilizados envolveram um toracoscópio com diâmetro de 5 ou 10 mm, conforme a necessidade de campo visual e angulação de lente de 30 graus. Os instrumentais (ESTECH® Inc., Califórnia, USA) idealizados especificamente para cirurgia cardíaca, incluíram: afastadores de átrio, tesouras, empurradores de nó, pinça de aorta, porta-agulha e contra porta-agulha.
Outros instrumentos como pinças, eletrocautério, câmeras de vídeo e fonte de luz foram os mesmos utilizados nas laparoscopias convencionais. Nos casos em que a CEC foi empregada, foram utilizados: um insuflador de CO2, para substituição do ar ambiente, e um manômetro com pressão negativa, para drenagem venosa "a vácuo". Os kits de canulação femoral arterial e venosa, idealizados para CEC periférica, foram utilizados em todos esses casos (DLP® Medtronic Inc., Minneapolis, USA).
Técnica cirúrgica passo-a-passo nos casos de CCVA com CEC periférica
1. Foram utilizados, no mínimo, dois acessos periféricos de bom calibre, para indução anestésicas;
2. Foi realizada intubação orotraqueal com cânula de Carlens® ou Portecs®, para oclusão do pulmão direito durante a cirurgia;
3. Após a introdução da cânula, assegurou-se a efetiva oclusão unilateral direita e manutenção da oxigenação com um único pulmão;
4. Foi necessária a canulação de ambas as artérias radiais com auxílio de endopinça aórtica, permitindo monitoramento do endopinçamento, para que este não migrasse e ocluísse os vasos da base. Em casos de pinçamento aórtico transtorácico, uma das artérias radiais foi suficiente;
5. Punção de vaso central, jugular ou subclávio para infusão de drogas e monitoração da pressão venosa central. Foi preferível sempre a punção do lado direito, pois uma complicação como pneumotórax não diagnosticada no lado esquerdo poderia ser gravíssima e impedir a oclusão do pulmão direito;
6. Pás adesivas para desfibrilação transtorácica foram coladas na região torácica esquerda, anterior e posterior;
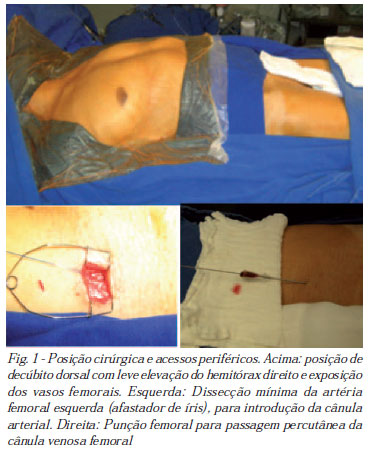
7. Nos casos com CEC, o hemitórax direito, bem como os vasos femorais, foram expostos pelos campos cirúrgicos. Um coxim elevava ligeiramente o hemitórax direito, para que ficasse exposta a linha axilar média (Figura 1);
8. A CEC foi montada de forma convencional, testada a rede de vácuo, com auxílio de um manômetro de pressão negativa conectado ao reservatório venoso do oxigenador. Esse teste foi feito durante o preenchimento do circuito e retirada de bolhas. Variações de 40 a 100 mmHg foram utilizadas para permitir drenagem venosa adequada;
9. Após a escolha do método de acesso periférico, foram dissecados ou puncionados os vasos femorais, ainda antes da heparinização (Figura 1). Os tubos de CEC direcionados para o campo operatório, posicionados sob os membros inferiores;
10. Iniciava-se a incisão torácica, após definição do melhor local de acesso. Esta incisão se fez em pele e subcutâneo. Nas mulheres, preconizou-se antecipar com uma caneta o local de incisão inframamária que é desviado na posição de decúbito. Em seguida, realizou-se uma incisão torácica inferior (quinto espaço intercostal com linha axilar anterior) para introdução do trocater, inicialmente utilizado pela câmara de vídeo, para auxiliar o ponto ideal da incisão intercostal. O mesmo trocater foi utilizado para colocação do aspirador de átrio esquerdo e, ao final da cirurgia, do dreno torácico;
11. Seguiu-se à dissecção do pericárdio e identificação do nervo frênico. Abriu-se o pericárdio, anteriormente ao nervo, desde a veia cava inferior até a aorta, próximo à fúrcula esternal. Em caso de acesso à valva aórtica, o pericárdio foi incisado mais alto, descendo somente até a visualização da aurícula direita. Pontos de exposição foram usados para manter o pericárdio aberto e tracionados na parede torácica;
12. Após heparinização plena, realizou-se a canulação dos vasos femorais, primeiramente a veia femoral, introduzindo-se um guia metálico rígido, progredindo até o átrio direito, confirmado com TEE. Dilatadores foram introduzidos sequencialmente para dilatar o vaso, até que a cânula, com dilatador oclusivo, fosse introduzida até o átrio direito, novamente sendo necessário assegurar sua posição com TEE. Depois de posicionada a cânula venosa, essa foi fixada na pele e conectada ao tubo venoso da CEC. O mesmo procedimento foi adotado com a canulação arterial, somente que, nesse caso, a progressão da cânula seguiu até seu comprimento máximo, na aorta abdominal. Conectada ao segmento arterial no tubo de CEC, se testava a permeabilidade e pulso;
13. Em casos de atriotomia direita (comunicação interatrial, comunicação interventricular ou cirurgia mitral por acesso transeptal), uma cânula de duplo estágio nº 22F (ESTECH®) foi introduzida pela veia femoral, com auxílio da TEE, até seu posicionamento na veia cava superior, seguido de cadarçamento de ambas as veias cavas. Em muitos casos, foi utilizada a canulação dupla, veia cava superior com cânula nº 16F ou 17F e veia cava inferior nº 21F, ambas DLP®. A opção pela canulação dupla foi sempre preferida, pois a cânula de duplo estágio, em algumas situações, em decorrência de sua presença sobre o campo cirúrgico, dificulta a visualização da lesão cardíaca;
14. Uma incisão de 2 cm foi realizada no segundo espaço intercostal com linha axilar anterior, para colocação da pinça transtorácica de Chitwood® (Figura 2);

15. Nesse momento, iniciou-se a CEC. A necessidade de maior ou menor drenagem foi orientada pelo cirurgião, que solicitava variações na pressão do vácuo;
16. Previamente ao pinçamento transtorácico, confeccionou-se uma bolsa na raiz aórtica, para introdução da cânula de cardioplegia, que foi usada ao final do procedimento também para retirada de ar das cavidades esquerdas. Essa mesma cânula foi retirada sempre em CEC e com baixo fluxo, buscando minimizar os riscos de dissecção da aorta;
17. Cardioplegia sanguínea hipotérmica 4/1 foi realizada a cada 15 minutos e a CEC mantida entre 28 e 30 graus. Nos casos em que foi utilizada solução de HTK (Custodiol®), somente uma infusão foi feita na raiz aórtica para realizar todo o procedimento, nos casos de insuficiência aórtica, a infusão foi realizada em óstios coronários [12];
18. Nesse momento, abria-se a cavidade cardíaca: atriotomia esquerda, septostomia, atriotomia direita ou aortotomia, conforme a doença cardíaca. Pontos de exposição foram utilizados para aorta e átrio direito e afastador de átrio esquerdo (ESTECH®), nas doenças mitrais;
19. Depois de completado o tempo cirúrgico principal, procurou-se ter muita atenção para máxima retirada de ar das cavidades cardíacas, também orientada pela TEE. O primeiro passo era realizar a posição máxima de Trendelenburg. Em doenças da aorta, a cânula de cardioplegia, instalada na raiz aórtica, foi suficiente para aspirar todo o ar residual no ventrículo esquerdo. Para a valva mitral, um "vente" de ventrículo esquerdo foi colocado através da valva, mantendo-a insuficiente. Nesse momento, a TEE confirmava a completa eliminação do ar das cavidades cardíacas, antes da saída de CEC. Períodos de interrupção de CEC com aspiração constante de raiz aórtica ajudavam na deaeração;
20. Um dreno torácico foi suficiente para drenagem, colocado na incisão inferior utilizada inicialmente para aspiração de átrio esquerdo.
21. Após revisão da hemostasia, iniciou-se administração de protamina por infusão contínua. Antes de se completar a reversão da heparina, retirava-se a cânula venosa. Considerando-se que a introdução foi normalmente percutânea, somente compressão local foi realizada;
22. Depois de revertida a anticoagulação, uma bolsa com fio prolene 4-0 foi confeccionada na artéria ao redor da cânula femoral, para oclusão após sua retirada;
23. Terminadas todas as suturas, supeficializava-se a anestesia e; sempre que possível; o paciente era extubado ainda na sala cirúrgica.
RESULTADOS
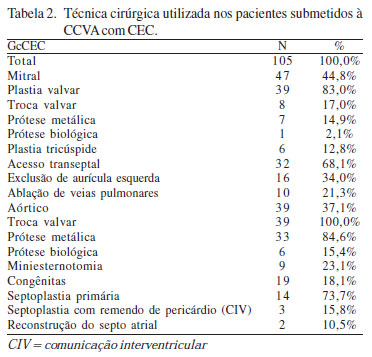
Cento e trinta e seis pacientes foram submetidos a CCVA. Trinta e um pacientes não foram operados com auxílio de CEC (GsCEC) e, em 105, CEC e cardiotomia foram empregadas (GcCEC), sendo os procedimentos cirúrgicos desse grupo apresentados na Tabela 2.
Grupo com CEC (GcCEC)
A maioria dos pacientes (101/105) foi submetida a pinçamento aórtico transtorácico com pinça de Chitwood® (ESTECH Inc., Califórnia, USA). Em quatro casos, todos submetidos à reoperação mitral, utilizamos alternativas ao pinçamento transtorácico: três pacientes foram submetido a hipotermia moderada com parada cardíaca em fibrilação ventricular e um paciente submetido a endopinçamento aórtico com cânula ESTECH®. Os primeiros 61 pacientes da série receberam cardioplegia sanguínea fria 4/1, de forma intermitente, na raiz aórtica, a cada 15 minutos, nos casos de insuficiência aórtica grave, os óstios coronários foram utilizados para infusão seletiva. Nos últimos 37 pacientes, utilizamos infusão única de solução de Custodiol®, em raiz aórtica ou óstios coronários, conforme a doença envolvida. Optou-se por essa solução em decorrência da comodidade da dose única e sua boa resposta sobre a função ventricular [12].
Valvopatia mitral
Quarenta e sete pacientes receberam tratamento cirúrgico da valva mitral e foram realizadas oito (17%) trocas valvares, 39 (83%) plastias, 10 (21,3%) cirurgias de Maze modificado e seis (12,8%) plastias de valva tricúspide. Nas trocas valvares, foram utilizadas próteses metálicas (St Jude Medical System®) e compreenderam pacientes que apresentavam dupla lesão mitral, com predomínio de estenose grave. Nos demais 39 pacientes, uma plastia mitral foi possível, e incluiu comissurotomia e miopapilotomia, nos casos de estenose pura, e implante de anel de Gregori®, comissurotomia, ressecção quadrangular de cúspide posterior e/ou transposição de cordoalhas, nos casos de predomínio de insuficiência mitral. Ablação por radiofrequência das veias pulmonares e exclusão da aurícula esquerda (Maze modificado) foi procedida nos casos de fibrilação atrial associada. Um paciente com comunicação interatrial e fibrilação atrial também foi submetido à ablação de veias pulmonares e átrio direito (Maze completo). Plastia tricúspide com redução anular foi realizada concomitantemente ao tratamento da valva mitral em seis pacientes. Nos últimos 32 (68,1%) pacientes, optamos pelo acesso transseptal para tratamento da valva mitral, por observamos resultados superiores ao do acesso transatrial realizado nos primeiros.
Um paciente incluído no grupo de doença mitral foi submetido a troca aórtica e mitral, em decorrência de insuficiência aórtica importante, subestimada pela ecocardiografia e que dificultou a cardioplegia anterógrada, sendo realizada em óstios coronários, após aortotomia. Três pacientes foram operados por endocardite de valva mitral, dois casos em situação eletiva e um caso em urgência, por insuficiência mitral aguda e acidente vascular cerebral embólico.
Nos pacientes com doença da valva mitral ou cardiopatia congênita, realizamos minitoracotomia direita de 3 a 5 cm, no 4º espaço intercostal esquerdo, nesses casos optamos pelo acesso inframamário ou periareolar, conforme a possibilidade anatômica e constituição física [13,14] (Figura 3).
Valvopatia aórtica
Nos 39 casos com doença aórtica, a troca valvar foi realizada em todos os pacientes. Optamos em 33 casos pelo implante de prótese metálica (St. Jude Medical System®). Seis pacientes com idade superior a 70 anos receberam implante de uma prótese biológica (Braile Biomédica®). Miniesternotomia superior em L invertido foi realizada em nove pacientes, por apresentarem calcificação valvar importante e dilatação da aorta ascendente. Nos demais casos (76,9%; 30/39), realizamos minitoracotomia anterolateral direita através do segundo ou terceiro espaço intercostal (Figura 4).
Cardiopatia congênita
Dezenove pacientes apresentavam cardiopatia congênita, 16 tinham comunicação interarterial, destes 14 foram tratados com ráfia primária. A inclusão de remendo de pericárdio bovino foi realizada somente em dois casos, em que foi encontrada ausência completa do septo atrial. Três pacientes apresentavam comunicação interventricular perimembranosa, que foi fechada com pericárdio bovino por acesso pelo átrio direito transpondo a valva tricúspide, nestes pacientes dois tinham comunicação interarterial associada e foram corrigidas por sutura primária.
Grupo sem CEC (GsCEC)
Terapia de Ressincronização Ventricular
Dezoito pacientes portadores de miocardiopatia dilatada, insuficiência cardíaca refratária e dissincronia ventricular grave foram submetidos a terapia de ressincronização ventricular. Nesses casos, foi implantado um ressincronizador biventricular. O implante de eletrodo epicárdico de ventrículo esquerdo foi realizado através de toracoscopia esquerda. A orientação pré-operatória da posição ideal do eletrodo epicárdico, bem como o controle pós-operatório da ressincronização, foi realizada por ecocardiografia tridimensional (Ecocardiógrafo IE-33, Philips Medical System). Em todos os casos, a ressincronização foi efetiva e sem intercorrências [15].
Fistula coronário-pulmonar
Três pacientes não incluídos no grupo GcCEC tinham fistula coronário-pulmonar tratadas com ligadura através de toracoscopia e dispositivos metálicos [16].
Tumor cardíaco
Ressecção de tumor extracardíaco (lipoma) aderido ao átrio esquerdo foi realizada em dois casos, um dos quais com 1 kg de peso. Um caso de neurohemangiolipoma aderido ao pericárdio e epicárdio também foi ressecado via toracoscopia. O quarto paciente apresentava miastenia gravis e timoma, que estava aderido aos vasos da base e também foi ressecado através de toracoscopia, sem toracotomia.
Revascularização miocárdica
Seis pacientes foram submetidos a revascularização isolada de artéria coronária descendente anterior, com implante de artéria mamária interna esquerda. O procedimento cirúrgico foi realizado em primeiro tempo com toracoscopia e dissecção da artéria torácica. Em seguida, foi realizada minitoracotomia em 4º espaço intercostal esquerdo, com incisão inframamária, para o implante coronário. Em todos os casos, foi utilizado conduto intracoronário sem uso de CEC. Nenhum paciente apresentou intercorrência e todos receberam alta hospitalar precoce.
Tempos cirúrgicos e complicações pós-operatórias
Os tempos operatórios e complicações pós-operatórias foram descritos nos casos em que se utilizou CEC associada às mínimas incisões e estão relacionados nas Tabelas 3 e 4.
Os tempos médios cirúrgicos foram 274,8 ± 58,8 min de sala operatória, 134,1 ± 58,8 min de CEC e 82,2 ±3 9,6 min de pinçamento aórtico. Os tempos totais de internação corresponderam a 2,4 ± 4,5 dias de UTI e 5,0 ± 6,8 dias de internação pós-operatória. A média de sangramento total aferido pelos drenos torácicos, no pós-operatório, foi de 523,5 ± 560,2 ml e a reposição de hemoderivados foi de 0,98 ± 1,47 unidades de concentrado de hemácias por paciente.
Doze (11,4%) pacientes apresentaram complicações no pós-operatório: três pacientes evoluíram com acidente vascular cerebral isquêmico, destes, dois transitórios com recuperação completa entre 24 e 48 horas de pós-operatório. Um caso permaneceu após a alta hospitalar com monoplegia e dislalia. Um paciente apresentou complicação vascular periférica no sítio de canulação arterial com trombose, que necessitou embolectomia e ráfia com retalho de pericárdio bovino, no segundo dia de pós-operatório. Essas complicações ocorreram somente nos casos de troca valvar aórtica, em pacientes com estenose grave e calcificação grave de anel e cúspides.
Uma paciente submetida a reoperação por estenose mitral apresentou hemorragia pulmonar no quarto dia de pós-operatório, após a alta da UTI e foi manejada, novamente na UTI, com ventilação mecânica. Outro paciente apresentou hemorragia pulmonar na saída da sala cirúrgica, provavelmente secundária a complicações da canulação seletiva, que cedeu no 3º dia de pós-operatório.
Cinco (4,8%) pacientes foram submetidos a reoperação por sangramento, todos através das mínimas incisões, somente com auxílio de videoscopia.
Cinco pacientes, todos do grupo GcCEC, foram a óbito (4,8% ou 5/105). Um paciente com insuficiência renal crônica em diálise, acidente vascular cerebral embólico recente e diagnóstico de endocardite de valva mitral, foi submetido a troca valvar com urgência, o óbito ocorreu no pós-operatório imediato, por sangramento excessivo, coagulopatia de consumo e choque cardiogênico irreversível. Um segundo paciente apresentava valvopatia mitro-aórtica e insuficiência tricúspide, recebendo dupla troca valvar e plastia tricúspide, mas foi a óbito no quinto dia de pós-operatório, por choque cardiogênico progressivo e refratário. O terceiro paciente com disfunção de prótese prévia foi submetido a reoperação para retroca valvar mitral, apresentou sangramento excessivo, ainda no transoperatório, quando foi diagnosticada ruptura de sulco atrioventricular, com óbito, apesar da tentativa de correção da complicação. Três pacientes portadores de estenose aórtica grave e muito calcificadas apresentaram dissecção da aorta e todos foram submetidos a troca da aorta ascendente. Dois pacientes foram a óbito, por sangramento e choque misto, um no 1º dia e o segundo no 5º dia de pósoperatório. Três desses casos foram convertidos para esternotomia mediana para correção da complicação cirúrgica e corresponderam a 2,9% dos casos GcCEC.
Noventa e três pacientes dos 105 operados (88,6%) não apresentaram complicações que alterassem sua evolução pós-operatória e obtiveram 122,8 ±4 8,2 min de CEC e 76,7 ± 35,6 min de pinçamento aórtico, 97,8% (91/93) foram extubados ainda na sala de cirurgia. A média de dias na unidade de terapia intensiva e o total de dias de internação hospitalar foram, respectivamente: 1,8 ± 0,9 dias e 3,6 ± 1,3 dias. Todos os dados, relacionando pacientes com e sem complicações, estão descritos na Tabela 5.
DISCUSSÃO
A visibilização endoscópica da cavidade pleural é técnica relativamente antiga. No início desse século, Jacobaeus realizou a primeira toracoscopia, introduzindo um cistoscópio na cavidade pleural [17]. Diversas operações foram idealizadas por esse autor através da toracoscopia, além da operação conhecida por seu nome, utilizada no tratamento da tuberculose. Os primeiros procedimentos cardíacos considerados minimamente invasivos vieram com as cirurgias de revascularização miocárdica sem CEC, já que neutralizando os efeitos supostamente deletérios da perfusão extracorpórea, estariam minimizando as complicações per-operatórias. Ankeny [18] e Kolessov [19] e Buffolo et al. [20-22], no Brasil, apresentaram seus relatos em anais internacionais. Lobo Filho et al. [23], em 1996, demonstraram 97% de revascularização miocárdica sem CEC na última fase de seu relato.
O conceito minimamente invasivo por mínimas incisões para cirurgias no coração ocorreu também nos meados dos anos noventa. Nesse início, introduziram-se as incisões menores para acesso às valvas mitral e aórtica e às artérias coronárias, como as hemiesternotomias superior ou inferior com transecção do esterno e as toracotomias laterais [24,25], ou ainda, toracotomia esquerda para revascularização única de artéria descendente anterior, e toracotomia direita, para acesso à valva mitral ou artéria coronária direita. A toracotomia anterolateral direita já tinha sido utilizada no passado com preferência nas doenças mitrais, mas foi descontinuada a partir dos melhores resultados com as toracotomias medianas ou esternotomias [26-28].
À exceção da revascularização miocárdica sem CEC, a cirurgia cardíaca com mínimas incisões, principalmente na valva aórtica, chegou a ser considerada impeditiva, diante da alta taxa de morbimortalidade quando comparada à cirurgia convencional. Bridgewater et al. [29] demonstraram 43% de morbimortalidade na cirurgia minimamente invasiva contra 7% nas cirurgias convencionais para tratamento da valva aórtica. Mesmo quando outros centros demonstravam resultados mais animadores, ainda assim não atraiam a atenção dos cirurgiões cardíacos no mundo [30].
Também nos últimos anos, utilizando acessos alternativos, implementou-se o implante percutâneo ou transapical de valva aórtica e os dispositivos endovasculares, desde endopróteses para aorta até anéis de redução anular para valva mitral e dispositivos para oclusão de fendas congênitas atrioventriculares [4-6,8].
Atualmente, a cirurgia cardíaca minimamente invasiva tem demonstrado melhores resultados com o auxílio da videoscopia, permitindo, inclusive, os maiores avanços da robótica na Medicina. Além dos equipamentos de vídeo direcionados para cirurgia cardíaca, a cirurgia minimamente invasiva implementou-se após a inclusão dos acessos extratorácicos e, nos últimos anos, do chamado "portaccess technology", ou seja, tecnologia para acesso vascular periférico e endopinçamento aórtico [10,31].
Desde 1995, são apresentados estudos multicêntricos para demonstrar a eficácia desse novo método. Galloway et al. [11], em 1999, reuniram dados de 121 centros, e incluíram 1.063 pacientes operados pelas técnicas minimamente invasivas, apresentando resultados similares aos da cirurgia convencional, com a vantagem da menor agressão, dor e uso de hemoderivados, além da alta hospitalar e retorno às atividades habituais muito mais precoces. Em 2009, o mesmo Dr. Galloway reportou seus dados de uma década de experiência com o método [2]. Também Grossi et al. [32] e Greco et al. [33], em 2002, e Mishra et al. [34], em 2005, relataram experiências altamente favoráveis da técnica videoassistida.
Além das experiências já relatadas, muitos centros utilizando a sofisticação tecnológica da robótica demonstraram suas experiências e, apesar do alto investimento, coroaram os métodos minimamente invasivos pela baixa mortalidade, mínima permanência em UTI e alta hospitalar muito precoce [35,36].
No Brasil, Jatene et al., em 1997, Souto et al., em 2000, e Salerno et al., também em 2000, relataram suas primeiras experiências com cirurgia videoassistida, mas ainda na periferia do coração. Somente a partir de 2005, com o início de nossa experiência [16,37,38] e da experiência de Poffo et al. [39], em 2006, começou uma nova fase da cirurgia cardíaca vídeo-assistida em nosso meio, incluindo os procedimentos intracavitários através de CEC periférica, assistência a vácuo e minitoracotomias.
Nossa experiência com CCVA teve início em 2005, com a ligadura de uma fístula coronário-pulmonar por meio de toracoscopia [16]. Seguimos no mesmo ano com nosso primeiro caso de tratamento da valva mitral com um procedimento totalmente endoscópico, em um caso de reoperação, no qual realizamos recomissurotomia [37]. Hoje, apresentamos nossa casuística de 136 pacientes operados pela técnica minimamente invasiva, incluindo procedimentos sobre a valva aórtica, mitral, cardiopatias congênitas e sobre a periferia do coração, como na ressincronização cardíaca, fístulas coronário-pulmonar, retirada de tumores extracardíacos e revascularização miocárdica minimamente invasíva. Optamos por incluir nas discussões principalmente os casos que exigiram o uso de CEC, em decorrência da maior complexidade desses procedimentos e maior uniformidade dos dados aferidos.
Os tempos cirúrgicos incluindo: CEC, pinçamento aórtico e uso da sala cirúrgica são maiores na cirurgia videoassistida do que com a esternotomia convencional, mesmo assim, os resultados têm sido mais favoráveis à técnica minimamente invasiva. Essa assertiva é bem demonstrada quando analisamos os grandes trabalhos publicados sobre o tema. Modi et al. [40], em 2009, apresentaram influência da CEC na morbidade, somente nos casos em que o tempo de bypass cardiopulmonar foi superior a 180 minutos. Modi et al. [3], por meio de grande meta-análise demonstraram que, apesar dos maiores tempos operatórios, houve melhora dos resultados pós-operatórios quando comparada a técnica minimamente invasiva à convencional. Apesar desse fato, e com o decorrer da experiência clínica, esses tempos se tornam menores, como também pudemos demonstrar em nossa série (Figura 5).

Nossa casuística demonstrou 2,4 ± 4,5 dias de internamento em UTI e 5,0 ± 6,8 dias de hospitalização. No grupo de cardiopatia congênita, esses tempos foram ainda menores, com 1,3 ± 0,5 dias em UTI e 2,6 ± 0,8 dias de internamento pós-operatório, números que demonstram o resultado esperado para essa técnica. Argenziano et al. [41] relataram 20 horas de UTI e 4 dias de hospitalização, Modi et al. [40], 6 dias de internamento hospitalar, e Poffo et al. [39], 6,5 dias de hospitalização.
Dos 47 pacientes com valvopatia mitral, 39 (83,0%) foram submetidos a reparo da valva, esse fato tem sido suportado por vários autores, sugerindo que a plastia mitral é mais frequentemente conseguida quando se utiliza a cirurgia cardíaca minimamente invasiva em comparação à esternotomia mediana. Modi et al. [40] demonstraram 82% de plastia valvar em sua série e também referiram em seus relatos estes melhores resultados na experiência de outros autores.
Também no grupo das doenças mitrais, em 32 (68,1%) casos optamos pela utilização do acesso transseptal, para tratar a valva mitral e os resultados foram melhores quando comparamos aos do acesso transatrial. Melhores tempos cirúrgicos, drenagem venosa não comprometida e o reparo do septo por pontos de tração sem a necessidade de afastadores de átrio foram observados e relatados em resumo de trabalho apresentado por nossa equipe em congresso recente [42]. Em cirurgias com esternotomia, esse acesso também tem sido comentado, oferecendo os mesmos benefícios que observamos [43]. Navia et al. [30], em seu relato com cirurgia minimamente invasiva, em 1996, já haviam demonstrado o uso do acesso transseptal em seus procedimentos para tratamento da valva mitral.
Em relação a complicações ocorridas em nossa série, observamos relatos semelhantes na literatura, principalmente nos casos que envolviam reoperação, troca valvar mitral e cirurgia sobre valva aórtica. Doze pacientes apresentaram intercorrências no pós-operatório, dentre eles, três casos de acidente vascular cerebral (3/105 ou 2,9%), todos pacientes com grave calcificação em valva aórtica, somente um evoluiu com sequelas. Também Modi et al. [40] referiram 2,6% de acidente vascular cerebral, em 12 anos de uso do método.
Nossa casuística reportou 4,8% de óbitos (5/105) no total de casos que utilizaram CEC, e ocorreram somente nos casos de tratamento da valva mitral (3/47 ou 6,4%) e aórtica (2/39 ou 5,1%). Nos pacientes com cardiopatia congênita, as complicações foram mínimas e não houve óbito. Em relação à mortalidade, o registro da "Society of Thoracic Surgeons Fall 2007 report" reportou até 6,1% de mortalidade nos casos de troca da valva mitral [44].
Uma complicação do endopinçamento aórtico muito referida na literatura [40,45,46] também ocorreu em nossa série. Uma dissecção de sulco atrioventricular e ruptura de ventrículo esquerdo foram observadas em uma paciente com cirurgia mitral prévia em que utilizamos o método. Apesar de relatos semelhantes de ocorrência também com esternotomia e pinçamento aórtico, optamos, como muitos, a não mais usar essa técnica. Uma opção nos casos de reoperação, como usada por nossa equipe, é a parada cardíaca em fibrilação ventricular hipotérmica, realizada em três pacientes. Na revista Circulation, em 2007, Casselman et al. [47] relataram o uso da cirurgia minimamente invasiva em reoperação de valva mitral com parada cardíaca em fibrilação ventricular, e consideraram a técnica como primeira opção em casos de reoperação mitral isolada.
Noventa e três pacientes não apresentaram intercorrências, 88,6% de nossa série, e tiveram tempos de internação pós-operatória bem como evolução cirúrgica excelentes. Noventa e um (97,8%) pacientes foram extubados na sala de cirurgia, permaneceram 1,8 ± 0,9 dias na UTI e receberam alta hospitalar com média de 3,6 ± 1,3 dias de pós-operatório. Os relatos semelhantes ao encontrado nesta série foram também referidos por Tatooles et al. [35] Reichenspurner et al. [36], quando utilizaram a robótica em suas cirurgias.
Utilizamos uma minitoracotomia intercostal direita na maioria de nossos casos. Em nove (23,1%) pacientes com doença aórtica, o acesso foi realizado com hemiesternotomia em L invertido. Optamos por esse acesso nos casos em que a aorta ascendente era muito dilatada ou a valva aórtica era muito calcificada, já que com esta técnica a visão direta facilita o pinçamento aórtico e o manuseio da valva comprometida. Outros acessos, como hemiesternotomia em "T invertido" ou "L para a esquerda", também têm sido sugeridos por alguns autores, mas estão associados a maior trauma, menor benefício estético e/ou anti-álgico [48-50]. Na maioria dos nossos pacientes aórticos, utilizamos o acesso via toracotomia anterolateral direita de 4 cm, no terceiro espaço intercostal.
Os defeitos septais também se incluem nas doenças de fácil acesso para os procedimentos mínimos. A inclusão da segunda cânula (jugular) é mandatória, devido à necessidade de isolamento do átrio direito. As veias cavas são cadarçadas e ou pinçadas via mínima incisão. As demais atitudes cirúrgicas são as mesmas dos procedimentos em valva mitral. Nossa casuística envolveu 19 pacientes com cardiopatias congênitas, incluindo três casos de comunicação interventricular, com resultado cirúrgico excelente. Dezoito pacientes tiveram extubação imediata na sala cirúrgica e permaneceram em média 1,3 ± 0,5 dias em UTI e 2,6 ± 0,8 dias no hospital.
Os três casos de fistula coronária foram incluídos no presente trabalho com o intuito de demonstrar a possibilidade de se utilizar a videocirurgia em situações eventuais, estimulando os cirurgiões na busca de acessos alternativos às incisões convencionais. Uma pesquisa feita na literatura atual não relatou outras experiências com essa técnica [16,38].
Além dos procedimentos aórticos e atrioventriculares, utilizamos a videocirurgia em 18 casos de ressincronização biventricular com implante de eletrodo epicárdico totalmente endoscópico. O implante de eletrodo epicárdico, via toracoscopia esquerda, para ressincronização cardíaca, está bem documentado na literatura [51]. Sua implementação foi estimulada devido ao grau variável de insucesso no implante via seio coronário. A nova técnica é simples e realizada de forma totalmente endoscópica, os acessos não se utilizam de toracotomia, como no método convencional, mas de três pequenas incisões para introdução do instrumental e fixação do eletrodo epicárdico ativo. A ecocardiografia tridimensional orientou esses procedimentos [15].
Revascularização miocárdica com mínimas incisões também foi relatada em nossa série e cursou com bom resultado cirúrgico e ausência de complicações. Utilizamos a videotoracocopia para dissecção da artéria torácica interna esquerda e minitoracotomia anterior esquerda para implante coronário. Vários autores já utilizaram essa técnica inclusive no Brasil [28,52], mas os maiores avanços na revascularização miocárdica minimamente invasiva têm sido demonstrados na atualidade. Os procedimentos cirúrgicos utilizando a robótica têm permitido a revascularização coronária multiarterial, de forma totalmente endoscópica [53,54].
Hoje, cada vez mais, utiliza-se no mundo a cirurgia minimamente invasiva para tratamento das doenças cardíacas, mas sua expansão e definitiva consagração dependerá da maior habilidade dos cirurgiões e equipe multidisciplinar [2,3,40]. O futuro é ainda mais promissor, pois, como já acontece em alguns centros, as mínimas incisões serão substituídas pelos procedimentos totalmente endoscópicos [53,54].
CONCLUSÃO
Os resultados encontrados nesta série são comparáveis aos da literatura mundial e confirmam o método como opção a técnica convencional. A busca de melhor resultado estético, redução do desconforto pós-operatório observados nas grandes toracotomias e a rápida recuperação pós-operatória são os maiores objetivos da técnica, obviamente aliados às baixas complicações já conquistadas com a cirurgia convencional.
REFERÊNCIAS
1. Gersak B, Sostaric M, Kalisnik JM, Blumauer R. The preferable use of port access surgical technique for right and left atrial procedures. Heart Surg Forum. 2005;8(5):E354-63. [MedLine]
2. Galloway AC, Schwartz CF, Ribakove GH, Crooke GA, Gogoladze G, Ursomanno P, et al. A decade of minimally invasive mitral repair: long-term outcomes. Ann Thorac Surg. 2009;88(4):1180-4. [MedLine]
3. Modi P, Hassan A, Chitwood WR Jr. Minimally invasive mitral valve surgery: a systematic review and meta-analysis. Eur J Cardiothorac Surg. 2008;34(5):943-52. [MedLine]
4. Rossi RI, Cardoso CO, Machado PR, Francois LG, Horowitz ES, Sarmento-Leite R. Transcatheter closure of atrial septal defect with Amplatzer device in children aged less than 10 years old: immediate and late follow-up. Catheter Cardiovasc Interv. 2008;71(2):231-6. [MedLine]
5. Chamié F, Chamié D, Ramos S, Tress JC, Victer R. Fechamento percutâneo das comunicações interatriais complexas. Rev Bras Cardiol Invas. 2006;14(1):47-55.
6. Gaia DF, Palma JH, Ferreira CBND, Souza JAM, Agreli G, Gimenes MV, et al. Implante transcateter de valva aórtica: resultados atuais do desenvolvimento e implante de uma nova prótese brasileira. Rev Bras Cir Cardiovasc. 2011;26(3):338-47. [MedLine]
7. Gaia DF, Palma JH, Ferreira CB, Souza JA, Agreli G, Guilhen JC, et al. Transapical aortic valve implantation: results of a Brazilian prosthesis. Rev Bras Cir Cardiovasc. 2010;25(3):293-302. [MedLine] Visualizar artigo
8. Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, et al; PARTNER Trial Investigators. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. New Engl J Med. 2010;363(17):1597-607.
9. Felger JE, Nifong LW, Chitwood WR Jr. Robotic cardiac valve surgery: transcending the technologic crevasse! Curr Opin Cardiol. 2001;16(2):146-51. [MedLine]
10. Baldwin JC. Editorial (con) re minimally invasive port-access mitral valve surgery. J Thorac Cardiovasc Surg. 1998;115(3):563-4. [MedLine]
11. Galloway AC, Shemin RJ, Glower DD, Boyer JH Jr, Groh MA, Kuntz RE, et al. First report of the Port Access International Registry. Ann Thorac Surg. 1999; 67(1):51-6.
12. Savini C, Camurri N, Castelli A, Dell'Amore A, Pacini D, Suarez SM, et al. Myocardial protection using HTK solution in minimally invasive mitral valve surgery. Heart Surg Forum. 2005;8(1):E25-7. [MedLine]
13. Poffo R, Pope RB, Toschi AP, Mokross CA. Plastia valvar mitral minimamente invasiva videoassistida: abordagem periareolar. Rev Bras Cir Cardiovasc. 2009;24(3):425-7. [MedLine] Visualizar artigo
14. Souza Neto O, Camargo W, Carvalho A, Sobrosa C, Abreu LM. Troca valvar mitral e reposicionamento do músculo papilar com neocordas de PTFE: cirurgia videoassistida via periareolar. Rev Bras Cardiol. 2010;23(3):202-5.
15. Fortunato JF, Branco Filho AA, Branco A, Martins ALM, Pereira ML, Ferraz JGG, et al. Ressincronização biventricular com implante de eletrodo em ventrículo esquerdo através de toracoscopia guiado por ecocardiografia tri-dimensional (ECO 3D). Tema livre apresentado no 36º congresso da SBCCV, Belo Horizonte, MG, 2009.
16. Fortunato Júnior JA, Branco Filho AA, Granzotto PCN, Moreira LMS, Martins ALM, Pereira ML, et al. Videotoracoscopia para fechamento de fistula coronáriopulmonar: relato de caso. Rev Bras Cir Cardiovasc. 2010;25(1):109-11. [MedLine]
17. Jacobaeus HC - Ueber die Moglichkeit die Zystocopie bei untersuchung scroses Hohlungen anzuweden. Much Med Wochenschr 1910;57:2090.
18. Ankeny JL. To use or not to use the pump oxygenator in coronary bypass operations. Ann Thorac Surg. 1975;19(1):108-9. [MedLine]
19. Kolessov VI. Mammary artery-coronary artery anastomosis as a method of treatment for angina pectoris. J Thorac Cardiovasc Surg. 1967;54(4):533-44.
20. Buffolo E, Gomes WJ, Andrade JC, Branco JN, Maluf MA, Palma JH, et al. Revascularização miocárdica sem circulação extracorpórea: resultados cirúrgicos em 1090 pacientes. Arq Bras Cardiol. 1994;62(3):149-53. [MedLine]
21. Buffolo E, Andrade JC, Succi JE, Leão LE, Cueva C, Branco JN, et al. Revascularização do miocárdio sem circulação extracorpórea: descrição da técnica e resultados iniciais. Arq Bras Cardiol. 1983;41(4):309-16. [MedLine]
22. Buffolo E, Andrade JC, Succi J, Leão LE, Gallucci C. Direct myocardial revascularization without cardiopulmonary bypass. Thorac Cardiovasc Surg. 1985;33(1):26-9. [MedLine]
23. Lobo Filho JG, Dantas MCBR, Rolim JGV, Rocha JA, Oliveira FM, Ciarline C, et al. Cirurgia de revascularização completa do miocárdio sem circulação extracorpórea: uma realidade. Rev Bras Cir Cardiovasc. 1997;12(2):115-21. Visualizar artigo
24. Cosgrove DM 3rd, Sabik JF, Navia JL. Minimally invasive valve operations. Ann Thorac Surg. 1998;65(6):1535-8.
25. Cosgrove DM 3rd, Sabik JF. Minimally invasive approach to aortic valve operations. Ann Thorac Surg. 1996;62(2):596-7. [MedLine]
26. Grossi EA, Galloway AC, Ribakove GH, Zakow PK, Derivaux CC, Baumann FG, et al. Impact of minimally invasive valvular heart surgery: a case-control study. Ann Thorac Surg. 2001;71(3):807-10. [MedLine]
27. Calafiore AM, Giammarco GD, Teodori G, Bosco G, D'Annunzio E, Barsotti A, et al. Left anterior descending artery grafting via left anterior small thoracotomy without cardiopulmonary bypass. Ann Thorac Surg. 1996;61(6):1658-63.
28. Lisboa LAF. Minitoracotomia para revascularização do miocárdio com artéria torácica interna em lesão isolada proximal na artéria coronária interventricular anterior ou na artéria coronária direita: estudo prospectivo de 120 pacientes [Tese de Doutoramento]. São Paulo:Faculdade de Medicina da Universidade de São Paulo;1999.
29. Bridgewater B, Steyn RS, Ray S, Hooper T. Minimally invasive aortic valve replacement through a transverse sternotomy: a word of caution. Heart. 1998;79(6):605-7. [MedLine]
30. Navia JL, Cosgrove DM 3rd. Minimally invasive mitral valve operations. Ann Thorac Surg. 1996;62(5):1542-4. [MedLine]
31. Morh FW, Falk V, Diegeler A, Walther T, van Son JA, Autschbach R. Minimally invasive port-access mitral valve surgery. J Thorac Cardiovasc Surg. 1998;115(3):567-74.
32. Grossi EA, Galloway AC, LaPietra A, Ribakove GH, Ursomanno P, Delianides J, et al. Minimally invasive mitral valve surgery: a 6-year experience with 714 patients. Ann Thorac Surg. 2002;74(3):660-3.
33. Greco E, Barriuso C, Castro MA, Fita G, Pomar JL. Port-Access cardiac surgery: from a learning process to the standard. Heart Surg Forum. 2002;5(2):145-9. [MedLine]
34. Mishra YK, Khanna SN, Wasir H, Sharma KK, Mehta Y, Trehan N. Port-access approach for cardiac surgical procedures: our experience in 776 patients. Indian Heart J. 2005;57(6):688-93. [MedLine]
35. Tatooles AJ, Pappas PS, Gordon PJ, Slaughter MS. Minimally invasive mitral valve repair using the da Vinci robotic system. Ann Thorac Surg. 2004;77(6):1978-82.
36. Reichenspurner H, Boehm D, Reichart B. Minimally invasive mitral valve surgery using three-dimensional video and robotic assistance. Semin Thorac Cardiovasc Surg. 1999;11(3):235-43. [MedLine]
37. Fortunato JF, Branco Filho AA, Branco A, Martins ALM, Pereira ML. Reoperação de valva mitral totalmente endoscópica: relato de caso. Rev Bras Cir Cardiovasc. 2008;23(3):411-4. [MedLine] Visualizar artigo
38. Fortunato Jr. JA, Branco Filho AA, Branco A, Martins ALM, Pereira ML, Ferraz JGG, et al. Padronização da técnica de cirurgia cardíaca videoassistida: experiência inicial. Rev Bras Cir Cardiovasc. 2008;23(2):183-9. [MedLine]
39. Poffo R, Pope RB, Selbach RA, Mokross CA, CIDRAL. Cirurgia cardíaca videoassistida: resultados de um projeto pioneiro no Brasil. Rev Bras Cir Cardiovasc. 2009;24(3):318-26. [MedLine] Visualizar artigo
40. Modi P, Rodriguez E, Hargrove WC 3rd, Hassan A, Szeto WY, Chitwood WR Jr. Minimally invasive video-assisted mitral valve surgery: a 12-year, 2-center experience in 1178 patients. J Thorac Cardiovasc Surg. 2009;137(6):1481-7. [MedLine]
41. Argenziano M, Oz MC, DeRose JJ Jr, Ashton RC Jr, Beck J, Wang F, et al. Totally endoscopic atrial septal defect repair with robotic assistance. Heart Surg Forum. 2002;5(3):294-300. [MedLine]
42. Fortunato JF, Branco Filho AA, Branco A, Martins ALM, Pereira ML, Ferraz JGG, ET al. Cirurgia valvar mitral videoassistida; acesso transeptal versus transatrial. Tema livre apresentado ao 37º Congresso da SBCCV, Belém, Pará, 2010.
43. Salerno TA, Suares M, Panos AL, Macedo FI, Alba J, Brown M, ET al. Resultados da abordagem transeptal para a valva mitral com coração batendo. Rev Bras Cir Cardiovasc. 2009;24(1):4-10. [MedLine] Visualizar artigo
44. STS, Society of Thoracic Surgeons Fall 2007 Report; 2007.
45. Casselman FP, Van Slycke S, Wellens F, De Geest R, Degrieck I, Van Praet F, et al. Mitral valve surgery can now routinely be performed endoscopically. Circulation. 2003;108(Suppl 1):II48-54. [MedLine]
46. Onnasch JF, Schneider F, Falk V, Mierzwa M, Bucerius J, Mohr FW. Five years of less invasive mitral valve surgery: from experimental to routine approach. Heart Surg Forum. 2002;5(2):132-5. [MedLine]
47. Casselman FP, La Meir M, Jeanmart H, Mazzarro E, Coddens J, Van Praet F, et al. Endoscopic mitral and tricuspid valve surgery after previous cardiac surgery. Circulation. 2007;116(11 Suppl):I270-5. [MedLine]
48. Suenaga E, Suda H, Katayama Y, Sato M, Yamada N. Limited upper sternotomy for minimally invasive aortic valve replacement. Kyobu Geka. 2000;53(12):1028-31. [MedLine]
49. Nair RU, Sharpe DA. Limited lower sternotomy for minimally invasive mitral valve replacement. Ann Thorac Surg. 1998;65(1):273-4. [MedLine]
50. Gundry SR, Shattuck OH, Razzouk AJ, del Rio MJ, Sardari FF, Bailey LL. Facile minimally invasive cardiac surgery via ministernotomy. Ann Thorac Surg. 1998;65(4):1100-4. [MedLine]
51. Navia JL, Atik FA, Grimm RA, Garcia M, Vega PR, Myhre U, et al. Minimally invasive left ventricular epicardial lead placement: surgical techniques for heart failure resynchronization therapy. Ann Thorac Surg. 2005;79(5):1536-44.
52. Jatene FB, Pêgo-Fernandes PM, Hayata AL, Arbulu HE, Stolf NA, Oliveira SA, et al. VATS for complete dissection of LIMA in minimally invasive coronary artery bypass grafting. Ann Thorac Surg. 1997;63(6 Suppl):S110-3. [MedLine]
53. Bonatti J, Schachner T, Bernecker O, Chevtchik O, Bonaros N, Ott H, et al. Robotic totally endoscopic coronary artery bypass: program development and learning curve issues. J Thorac Cardiovasc Surg. 2004;127(2):504-10. [MedLine]
54. Bonatti J, Rehman A, Schwartz K, Deshpande S, Kon Z, Lehr E, et al. Robotic totally endoscopic triple coronary artery bypass grafting on the arrested heart: report of the first successful clinical case. Heart Surg Forum. 2010;13(6):E394-6. [MedLine]
Article receive on quarta-feira, 19 de outubro de 2011
 All scientific articles published at rbccv.org.br are licensed under a Creative Commons license
All scientific articles published at rbccv.org.br are licensed under a Creative Commons license